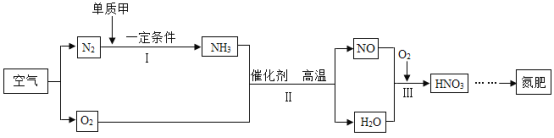
题目内容
【题目】如图是某品牌补铁剂的标签,请根据标签的有关信息完成下列各题.

(1)富马酸亚铁中氢原子和氧原子的个数比为________.
(2)富马酸亚铁中铁元素的质量分数为______(精确到0.1%).
(3)若每天服用1包该补铁剂,射入铁元素的质量为_______mg.
【答案】1:2 32.9% 66mg
【解析】
(1)富马酸亚铁(C4H2FeO4)中H、O元素的原子个数比为2:4=1:2,答:富马酸亚铁中H、O的原子个数比是1:2;
(2)富马酸亚铁中铁元素的质量分数为![]() ×100%≈32.9%,答:富马酸亚铁中铁元素的质量分数是32.9%;
×100%≈32.9%,答:富马酸亚铁中铁元素的质量分数是32.9%;
(3)根据物质中含某元素的质量=该物质的质量×某元素的质量分数,可得:每次服用1包该补铁剂,摄入铁元素的质量为:0.2g×32.9%=0.0658g≈66mg。

 53随堂测系列答案
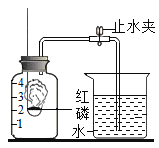
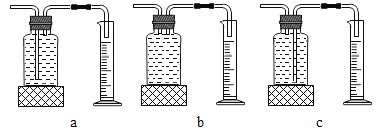
53随堂测系列答案【题目】实验室常用高锰酸钾制取氧气,可能用到的装置如图所示。
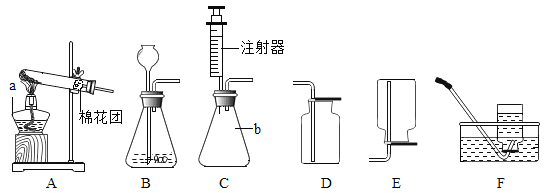
(1)本实验可选用的发生和收集装置为________(填字母)。
(2)取一定量的高锰酸钾固体,充分加热,发现实际产生氧气量远高于理论值,则可能的原因有________(测定过程中产生的误差可忽略)。
(3)某同学进行该实验并用排水法收集O2.下列操作正确的是__(填字母)
A 未检查装置气密性即向大试管中加入高锰酸钾固体
B 当导管口有连续气泡均匀冒出时,开始收集氧气
C 集气瓶中氧气收集满后,先用玻璃片盖住集气瓶口,再将其移出水面
D 气体收集完毕后,先熄灭酒精灯,再将导管移出水面
(4)实验室也可用双氧水制氧气。某同学为研究MnO2粉末用量对双氧水分解速率的影响,做了以下实验:采用不同质量的MnO2粉末做催化剂,每次均用30mL 10%的双氧水(其他实验条件均相同),测定收集500mL氧气所用的时间,结果如表:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
MnO2用量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 |
所用时间/s | 17 | 8 | 6 | 3 | 2 | 2 | 2 | 2 | 2 |
①写出上述反应的符号表达式: ________,该反应的基本类型是__________。
②该实验可得出的结论是______________。
③若上述实验选用B做发生装置,也可以制取氧气则长颈漏斗下端管口必须浸没在液体中,原因是_______。若选用C做发生装置,你认为选用装置C的优点是____________。
④在实验中也可以将注射器连接到装置B的导管口处,用来_________。
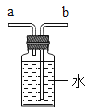
(5)实验室需少量甲烷气体,可用加热无水醋酸钠与碱石灰两种固体混合物制得。制甲烷气体的发生装置应选用________(填字母)装置,收集甲烷气可选用E或F装置,由此推断甲烷气具有的物理性质是_____________,若用如图装置收集该甲烷,气体由______端通入(填“a”或“b”)
(6)在实验室里制取氧气,既可采用分解过氧化氢的方法,也可采用分解氯酸钾的方法。上述两种方法的主要共同点有___________。
①采用MnO2均可改变其反应速率 ②反应都不需加热
③都利用含氧物质的分解来达到目的 ④两种方法所需仪器相同。
A ①③ B ③ ④ C ①② D ②④
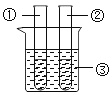
(7)某同学在学习了MnO2对H2O2的分解的催化作用之后,对催化剂产生了浓厚的兴趣。于是,他设计下表所示实验,探究金属铜对H2O2分解速率的影响。
操 作 | 装 置 | 现 象 |
1.取一个铜丝网,卷成筒形,固定在铁丝上。 |
| |
2.分别向①和②中注入15mL、30%的H2O2溶液,并放入盛有热水的③中。 |
| 约1min后可观察到①和②中都有少量气泡产生。 |
3.把铜丝网插入①中。 |
| ①中有大量气泡产生,5min后不再有气泡产生;此时②中仍然不断有少量气泡产生。 |
回答下列问题:
(a)仪器②在实验中的目的是_____________
(b)能否可以得出铜可以加快H2O2分解的速率_______(填“是”或“否”)理由是_______。
(c)如果用上述实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是_____。
A 称量实验前铜丝网的质量并将实验后的铜丝网干燥称重
B 向仪器②中加入二氧化锰
C 将实验后的铜丝网插入AgNO3溶液中(已知铜可以和AgNO3溶液反应生成银白色固体)
D 将铁丝换成铜丝
E 将过氧化氢溶液稀释
(d)该同学查阅资料得知,CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是___________。
A MnO2只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质不可能是其他反应的反应物或生成物
【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?
(设计并完成实验)
Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将xg氯酸钾与1.0g氧化铜均匀混合加热
(实验现象分析)Ⅲ中x的值应为_____,将实验Ⅰ和Ⅲ比较可证明_____,将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和xg氯酸钾混合加热,现象与实验Ⅲ相同,此步骤是为了证明氧化铜在该化学反应前后_____和_____都不变。
(结论1)氧化铜也能作氯酸钾分解的催化剂,请写出实验Ⅲ中的化学反应文字表达式_____。
(继续探究)小组同学完成上述实验后,又深一步进行“氧化铜用量与一定质量氯酸钾
制取氧气反应速率关系”的探究,下表是他们的有关实验数据,请你回答有关问题:
氧化铜与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
(分析整理)据上表可知氧化铜用量过多,产生氧气的速率_____(填“变快”、“变慢”或“不变”),氧化铜与氯酸钾的质量比为_____时,反应速率最快。
(结论2)在化学反应中催化剂的用量_____(填“是”或“不是”)越多越好。
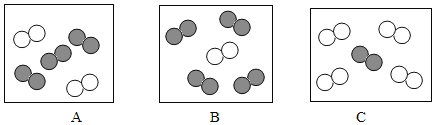
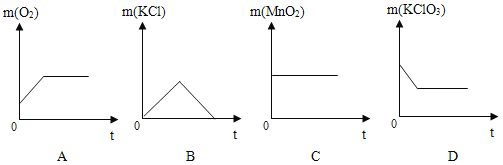
(能力提升)在一定质量的氯酸钾中加入少量的氧化铜并加热到不再产生气体为止,下图中能正确表示反应前后各物质的质量变化(m)与时间(t)关系的是_____。
(提出问题)②双氧水分解速度还和什么因素有关。
(设计并完成实验)
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2体积的装置是_____(填编号)。
(结论3)在相同条件下,双氧水的_____,双氧水分解得越快。
【题目】如图所示,将少量液体X加入烧瓶中,观察到气球逐渐膨胀。下表中液体X和固体Y的组合,符合题意的是( )
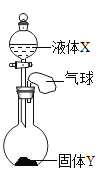
① | ② | ③ | ④ | |
| 过氧化氢溶液 | 水 | 水 | 水 |
| 二氧化锰 | 氯化钠 | 氢氧化钠 | 硝酸铵 |
A. ①②B. ①③C. ①③④D. ②③④