题目内容
【题目】请根据下列装置,回答问题:
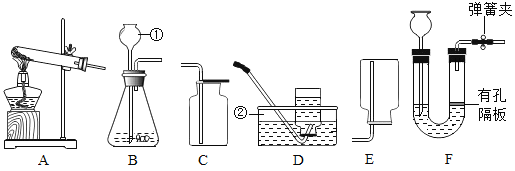
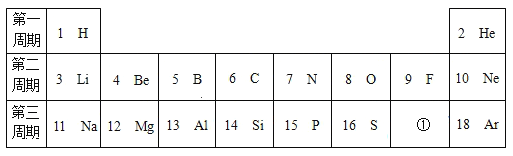
(1)写出标号①②的仪器名称:①______________,②______________
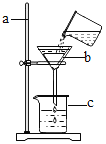
(2)实验室用锌和稀硫酸制取较纯净的![]() ,可选的装置组合是______________(填写装置序号)
,可选的装置组合是______________(填写装置序号)
(3)用装置B或F均可用于制取![]() 气体与B相比,F装置的优点是______________
气体与B相比,F装置的优点是______________
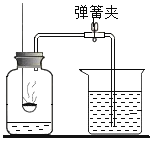
(4)用高锰酸钾制取![]() 化学反应方程式____________________________
化学反应方程式____________________________
(5)实验室常用氯化铵固体与碱石灰固体共热来制取氨气(![]() ).常温下
).常温下![]() 是一种无色.有刺激性气味的气体,密度比空气小,极易溶于水,对人体特别是粘膜组织有腐蚀作用.
是一种无色.有刺激性气味的气体,密度比空气小,极易溶于水,对人体特别是粘膜组织有腐蚀作用.
①制取氨气反应的化学方程式: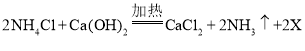 ,X的化学式为:__________________
,X的化学式为:__________________
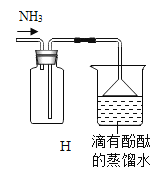
②制取并收集![]() ,从上图中选择______________和下图连接,用如图H装置收集氨气时,观察___________说明氨气已收满.
,从上图中选择______________和下图连接,用如图H装置收集氨气时,观察___________说明氨气已收满.
③干燥时不能选用下列干燥剂中的____________________________(填序号)
A 固体氢氧化钠 B 浓硫酸 C 生石灰.
【答案】长颈漏斗 水槽 BD或FD 可以随时控制反应的发生和停止 ![]()
![]() A 滴有酚酞的蒸馏水变红 B
A 滴有酚酞的蒸馏水变红 B
【解析】
(1)标号①②的仪器名称分别为长颈漏斗、水槽
(2)实验室用锌和稀硫酸制取较纯净的![]() ,反应物为固体和液体,选择固液不加热型发生装置(B或F),氢气难溶于水且密度比空气密度小,可以用排水法和向下排空气法收集,用排水法(装置D)收集较纯净的气体,因此可选的装置组合是BD或FD
,反应物为固体和液体,选择固液不加热型发生装置(B或F),氢气难溶于水且密度比空气密度小,可以用排水法和向下排空气法收集,用排水法(装置D)收集较纯净的气体,因此可选的装置组合是BD或FD
(3)用装置B或F均可用于制取![]() 气体F装置中打开弹簧夹,U型管右端液面上升,石灰石与稀盐酸接触产生二氧化碳气体,关闭弹簧夹,气压增大,液体与固体分离,反应停止,因此与B相比,F装置的优点是可以随时控制反应的发生和停止
气体F装置中打开弹簧夹,U型管右端液面上升,石灰石与稀盐酸接触产生二氧化碳气体,关闭弹簧夹,气压增大,液体与固体分离,反应停止,因此与B相比,F装置的优点是可以随时控制反应的发生和停止
(4)用高锰酸钾制取![]() ,高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,反应的化学反应方程式为
,高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,反应的化学反应方程式为![]()
(5)①制取氨气反应的化学方程式: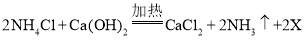 ,由反应原理和质量守恒定律,反应前后原子的种类和数目保持不变,2X中含有4个氢原子和2个氧原子,则X的化学式为
,由反应原理和质量守恒定律,反应前后原子的种类和数目保持不变,2X中含有4个氢原子和2个氧原子,则X的化学式为![]()
②由题意,实验室常用氯化铵固体与碱石灰固体共热来制取氨气,选择固固加热型发生装置,氨气的密度比空气密度小,极易溶于水,用向下排空气法收集氨气,制取并收集![]() ,上图中的装置A和下图连接,用如图H装置收集氨气,左边集气瓶为向下排空气法收集氨气,氨气溶于水,溶液呈碱性,可以使酚酞溶液变红,右边滴有酚酞的蒸馏水的烧杯用来吸收氨气,防止污染,并验满,观察到滴有酚酞的蒸馏水变红,说明氨气已收满,由于氨气极易溶于水,倒置的漏斗可以防止倒吸。
,上图中的装置A和下图连接,用如图H装置收集氨气,左边集气瓶为向下排空气法收集氨气,氨气溶于水,溶液呈碱性,可以使酚酞溶液变红,右边滴有酚酞的蒸馏水的烧杯用来吸收氨气,防止污染,并验满,观察到滴有酚酞的蒸馏水变红,说明氨气已收满,由于氨气极易溶于水,倒置的漏斗可以防止倒吸。
③A、固体氢氧化钠与氨气不反应,可以干燥氨气,A选项不正确,不符合题意;
B、浓硫酸与氨气反应生成硫酸铵,不能用来干燥氨气,B选项正确,符合题意;
C、生石灰与氨气不反应,可以干燥氨气,C选项不正确,不符合题意。故选B。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】可溶性酸、碱、盐在水中可解离出阴阳离子,我们现阶段所学的复分解反应的实质就是酸、碱、盐解离出的一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据如下所列溶解性表及氢氧化钠溶液和盐酸反应的微观示意图回答问题。
部分碱和盐的溶解性表(20℃)
阴离子 | 阳离子 | ||
Na+ | K+ | Ba2+ | |
OH- | 溶 | 溶 | 溶 |
SO42- | 溶 | 溶 | 不溶 |
CO32- | 溶 | 溶 | 不溶 |
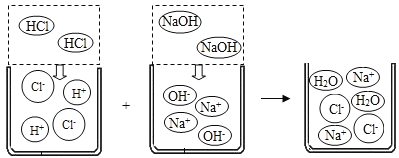
(1)如上图所示,HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推H2SO4在水中会解离出的离子是____________(填离子符号)。
(2)根据上述微观示意图写出化学反应方程式____________,判断反应前后溶液中数目发生变化的离子是____________(填离子符号)。
(3)根据溶解性表及复分解反应的实质判断,将“H2SO4、BaCl2、NaOH、K2CO3”四种物质的溶液两两混合,能发生的反应有________________________个。