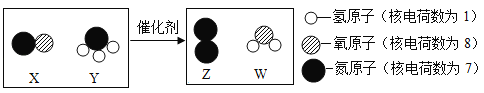
题目内容
【题目】某同学研究亚硫酸钠(化学式为 Na2SO3)热分解反应时,作了两种假设:
假设一:它按 CaCO3 受热方式来分解。
假设二:它按 KClO3 受热分解方式来分解。
(1)假设一对应的化学方程式是________。确认假设二是否成立的简单实验操作是_____。
(2)该同学将取一定质量的样品置于坩埚中充分灼烧,发现最终得到固体质量较原样品质量增加了大约 12.7%。据此他认为_(选填编号)。
a 假设一成立
b 假设二成立
c 两种假设均不成立
固体质量增加可能的原因是________。
(3)在查阅资料后,该同学再次进行了实验。他将一定质量样品置于密闭真空容器中充分加热,最终得到固体质量与原样品相同。但进一步分析表明,该固体组成为两种新的钠盐,其物质的量之比为 1:3。请写出相应的化学方程式_。
(4)该同学想要进一步探究次氯酸钠(化学式 NaClO)的分解反应。他查阅资料后,得知NaClO 有多种热分解方式(每种分解方式的产物仅有两种)。若其中一种产物为 NaCl,则另一种产物可能是:________(选填编号)。
a Cl2
b O2
c Na2O
d NaClO3
【答案】![]() 将带火星的木条伸到试管口,观察木条是否复燃 c 亚硫酸钠与氧气(或空气中的物质)发生化合反应生成新的固体物质
将带火星的木条伸到试管口,观察木条是否复燃 c 亚硫酸钠与氧气(或空气中的物质)发生化合反应生成新的固体物质 ![]() bd
bd
【解析】
假设二:
(1)CaCO3 在高温条件下分解生成氧化钙和二氧化碳,若Na2SO3按 CaCO3 受热方式来分解,则生成氧化钠和二氧化硫,反应的化学方程式是![]() 。若按 KClO3 受热分解方式来分解,则会生成硫化钠和氧气,确认假设二是否成立的简单实验操作是:将带火星的木条伸到试管口,观察木条是否复燃,若木条复燃则假设二成立。
。若按 KClO3 受热分解方式来分解,则会生成硫化钠和氧气,确认假设二是否成立的简单实验操作是:将带火星的木条伸到试管口,观察木条是否复燃,若木条复燃则假设二成立。
(2)若亚硫酸钠按上述两种方式受热分解,均会生成气体,固体都会质量减少,而实际实验最终得到固体质量较原样品质量增加了大约12.7%,故两种假设均不成立;实际实验得到固体质量较原样品质量增加,可能是因为亚硫酸钠与氧气(或空气中的物质)发生化合反应生成新的固体物质;故填:c;固体质量增加可能的原因是:亚硫酸钠与氧气(或空气中的物质)发生化合反应生成新的固体物质。
(3)由于亚硫酸钠加热分解得到的两种固体组成为两种新的钠盐,其物质的量之比为 1:3,根据质量守恒定律,其发生反应的化学方程式为:![]() 。
。
(4)NaClO热分解有两种产物,其中一种产物为NaCl,模仿亚硫酸钠和氯酸钾分解的化学反应,推测另一种产物可能是O2或NaClO3。故填:bd。

 53随堂测系列答案
53随堂测系列答案【题目】下列实验中,现象与结论对应关系正确的是
实验 | 现象 | 结论 | |
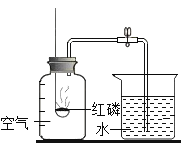
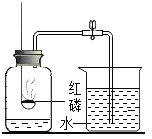
A |
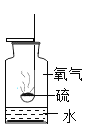
| 冷却后,打开弹簧夹,水被吸入瓶内,瓶内水面上升约1/5 | 氧气约占空气质量的1/5 |
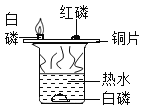
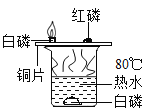
B |
| 铜片上的白磷燃烧,热水中的白磷不燃烧 | 燃烧需要达到可燃物的着火点 |
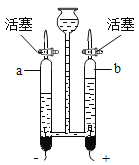
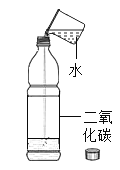
C |
| a中的气体能燃烧,产生淡蓝色火焰,b中的气体能使燃着的木条燃烧更旺 | 水是由氧气和氢气组成 |
D |
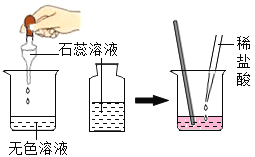
| 滴有紫色石蕊的溶液呈蓝色,加入稀盐酸后蓝色变为红色 | 反应后的溶液中一定不含碱性物质 |
A.AB.BC.CD.D