题目内容
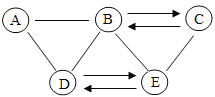
【题目】已知A、B、C、D、E分别为初中化学常见的物质,其中A、B、D、E分别为氧化物、酸、碱、盐中的一种,C是实验室中最常用的溶剂,D广泛用于玻璃、造纸、纺织和洗涤剂的生产,它们的部分反应和转化关系如图所示。(“一 ”表示两种物质能发生反应,“→”表示一种物质能转化成另一种物质,且省略部分反应物或生成物及反应条件)
(1)D的化学式为_________________。
(2)B与D在溶液中发生反应的现象_________________。
(3)写出E→D反应的化学方程式_________________。
(4)A--B的反应的基本类型是_________________。
【答案】Na2CO3 产生白色沉淀 ![]() 复分解反应
复分解反应
【解析】
根据图框分析推测,C是实验室中最常用的溶剂,则C是水;D广泛用于玻璃、造纸、纺织和洗涤剂的生产,则D是碳酸钠;碳酸钠和E可以相互转化,且E能与水反应,则E为二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠与盐酸反应可生成二氧化碳气体,二氧化碳能与水反应生成碳酸;A、B、D、E分别为氧化物、酸、碱、盐中的一种,且B与水相互转化,B为碱,并能与碳酸钠反应,则B为氢氧化钙;A为酸,可为盐酸或硫酸。经过验证,推测合理。
(1)D是碳酸钠,化学式为Na2CO3。
(2)B与D在溶液中发生反应是碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,故可观察到有白色沉淀产生。
(3)E→D反应是二氧化碳与氢氧化钠反应生成碳酸钠和水,化学方程式为![]() 。
。
(4)A--B的反应是酸与碱发生中和反应,反应的基本类型属于复分解反应。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】某课外兴趣小组的同学对二氧化碳的制取和性质进行相关探究。
(实验回顾)(1)实验室用大理石与稀盐酸制取二氧化碳的化学方程式为_______________。
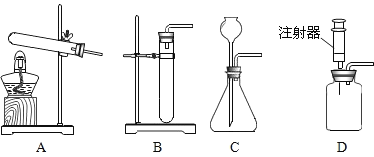
(2)下图可用于实验室制取CO2发生装置的是__________(填字母)。
(实验探究)CO2与NaOH溶液反应
(查阅资料)
(1)过量CO2通入NaOH溶液,发生两步反应。
第一步:____________________________(用化学方程式表示)
第二步:Na2CO3+H2O+CO2=2NaHCO3
(2)Na2CO3和NaHCO3部分溶解度表
温度/℃ | 0 | 15 | 20 | 30 | 40 | 50 | 60 |
NaHCO3/g | 6.9 | 8.72 | 9.6 | 11.1 | 12.7 | 14.45 | 16.4 |
Na2CO3/g | 7.1 | 13.25 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
(实验设计)在室温为15℃时,将10gNaOH固体完全溶解于80g水中,而后匀速通入CO2,同时用传感器测定溶液的pH变化,结果如图1所示。多次重复实验,所得实验结果基本一致。
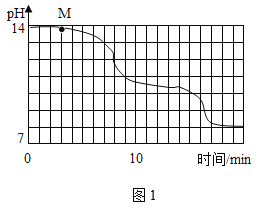
(1)通过图像分析,NaHCO3溶液显_____(填“酸性”、“中性”或“碱性”)。
(2)为了确定M点溶液的成分,同学们进行如下实验:
实验步骤 | 实验现象 | 初步实验结论 |
①取样,滴加过量的BaCl2溶液 | 产生白色沉淀 | 含有Na2CO3、NaOH |
②在①反应后的上层清液中滴加____ | _____ |
(3)实验过程中,同学们发现18min后溶液的pH基本不再变化,则此时溶液中可观察到的现象是______________________________。
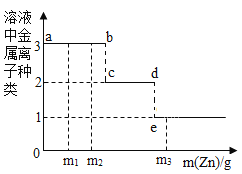
(拓展延伸)某同学向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的稀盐酸,测得消耗盐酸与生成CO2的质量之间关系如图2、图3所示。(忽略CO2在水中的溶解)

(1)图2中A点溶液中的溶质是_________(写化学式 ),图3中从B点开始的变化关系与图2完全重合,图3中B点溶液中的溶质是__________(写化学式)。
(2)写出OB段发生反应的化学方程式______________________________。
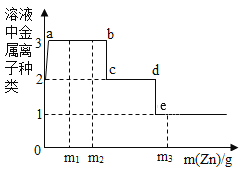
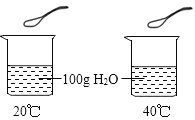
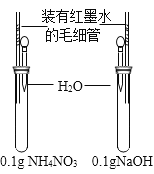
【题目】补全实验方案。请从A ~ C中任选二个作答,若均作答,按前二个计分。
序号 | 目的 | 操作 | 现象 | 结论 |
A | 验证温度对KNO3溶解度的影响 |
均加入_____KNO3固体 已知:20 ℃和40 ℃时,KNO3溶解度分别为31.6 g和63.9 g 装有红墨水 的毛细管 | 20℃时固体部分溶解,40℃时固体全部溶解 | KNO3的溶解度随温度的升高而增大 |
B | 研究NH4NO3和NaOH溶解时的温度变化 |
| __________ | NH4NO3溶解时温度降低;NaOH 溶解时温度升高 |
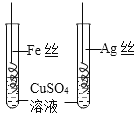
C | 比较Fe、Cu和Ag的金属活动性顺序 |
| Fe丝表面有红色固体析出,Ag丝表面无明显现象 | __________ |