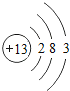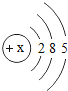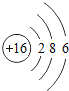题目内容
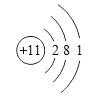
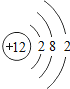
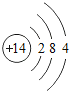
【题目】下表为元素周期表中某一周期元素的原子结构示意图。
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | CI | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
请回答下列问题:
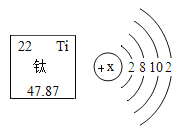
(1)表中磷原子的核电荷数x=____________;
(2)表中具有相对稳定结构的元素是______________;
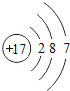
(3)在化学反应中,每个铝原子失去________________个电子形成铝离子;
(4)镁元素与氟元素形成化合物的化学式为___________________;
(5)上述元素在周期表中处于第________________周期,处于同一周期的原因是_______________。
【答案】15 氩 3 MgCl2 3 它们原子的核外电子层数相同
【解析】
(1)磷原子的核电荷数=质子数=核外电子数,故x=2+8+5=15;
(2)原子最外层电子数为8(只有一层为2),属于稳定结构,具有相对稳定结构的元素是氩元素;
(3)铝原子最外电子数为3,在化学反应中,每个铝原子失去3个电子形成铝离子;
(4)镁原子最外层有2个电子,形成化合物容易失去2个电子变为镁离子,氟原子最外层有7个电子,形成化合物溶于得到1个电子,镁元素和氟元素形成的化合物为氟化镁,化学式为MgF2;
(5)原子核外电子层数=周期数,上述元素的原子结构中都含有3层电子,在周期表中处于第3周期,处于同一周期的原因是:它们原子的核外电子层数相同。

【题目】化学实验室常用到氢氧化钠溶液,当多次揭开其瓶盖后,同学们猜想该试剂可能变质了,在征得老师同意后,开展了以下探究:
[提出问题1]该瓶氢氧化钠溶液是否变质了?
[实验探究1]
实验操作 | 实验现象 | 实验结论 |
取少量该溶液于试管中,滴加足量稀盐酸 | _____, | 氢氧化钠溶液一定变质了 |
该步骤中发生反应的化学方程式为_____。
[提出问题2]该瓶氢氧化钠溶液是全部变质还是部分变质呢?
[查阅资料]氯化钙溶液、氯化钠溶液均星中性,碳酸钠溶液星碱性。
[实验探究2]
实验操作 | 实验现象 | 实验结论 |
①取少量该溶液于试管中,滴加过量的CaCl2溶液,并不断振荡 | _____, | 原溶液中一定含有Na2CO3 |
②取步骤①试管中的少量上层清液.滴加酚酞溶液 | 溶液变为红色 | 原溶液中一定含有_____, |
[反思评价] .
(1)上述步骤①中滴加过量CaCl2溶液的目的是_____。
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案_____,(填“可行”或“不可行”),原因是_____。