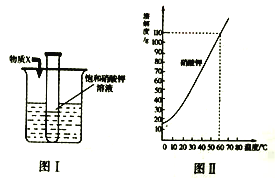
题目内容
【题目】某小组同学在用过氧化氢溶液与MnO2制取氧气的过程中,发现反应的速度很慢,产生的气泡很少。为此,他们进行了如下探究。
(猜想与假设)
①速度慢、气泡少可能与过氧化氢溶液的浓度有关。
②速度慢、气泡少可能与MnO2的质量有关。
(进行实验)根据下图进行如下实验。
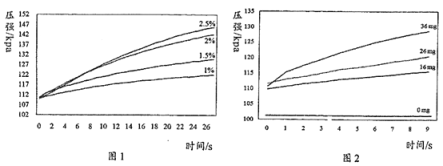
实验1:用26 mg MnO2与5 mL不同浓度过氧化氢溶液进行实验,压强变化如图1。
实验2:用5 mL 1.5%过氧化氢溶液与不同质量MnO2进行实验,压强变化如图2。
(解释与结论)
(1)实验1得到的结论是______________________________。
(2)实验2的目的是________________________________。
(3)小组同学在制氧气过程中,发现反应的速度很慢,依据上述实验所得结论,推测其原因可能是_____________。
(反思与评价)
(4)利用上图装置探究“温度对过氧化氢分解速率”的影响,是否合理?理由是_____________________。
【答案】相同质量的二氧化锰,相同体积的过氧化氢溶液的情况下,过氧化氢溶液浓度越大,过氧化氢分解速度越快,产生气泡越多 探究速度慢、气泡少是否与MnO2的质量有关 过氧化氢溶液浓度低、MnO2质量小、过氧化氢溶液浓度低同时MnO2质量小 不合理,因为温度对压强也有影响,会影响到反应速率的快慢判定
【解析】
(1)根据实验1对应的图标可以看出,在相同的时间内,质量分数越大的过氧化氢容易导致装置内的压强越大,也就是生成的氧气越多,即反应越快,所以实验1得到的结论是相同质量的二氧化锰,相同体积的过氧化氢溶液的情况下,过氧化氢溶液浓度越大,过氧化氢分解速度越快,产生气泡越多;
(2)根据实验2对应的图标可以看出,在相同的时间内,加入的二氧化锰的质量越大的过氧化氢容易导致装置内的压强越大,也就是生成的氧气越多,即反应越快,实验2的目的是探究速度慢、气泡少是否与MnO2的质量有关;
(3)小组同学在制取氧气过程中,发现反应的速度很慢,根据上面的实验可以从过氧化氢的浓度以及二氧化锰的量的角度分析,且是结合较少分析,所以产生的气泡很少的原因可能是过氧化氢溶液浓度低、MnO2质量小、过氧化氢溶液浓度低同时MnO2质量小;
(4)利用图1装置探究“温度对过氧化氢分解速率”的影响,由于水受热转化为水蒸气导致气压变化,即温度对压强也有影响,会影响到反应速率的快慢判定,用该装置进行探究不合理。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】在2016年巴西里约奥运会上,小红与同学发现游泳池池内水呈蓝色,对“蓝色水”产生好奇,于是她用一个洗净的可乐瓶装满一瓶“蓝色水”,进行探究:
[提出问题]“蓝色水”中的溶质是什么?
[猜想]小红经过查阅资料和自己学过的化学知识,她猜溶质可能是_____。
[查阅资料]含有铜离子的溶液一般呈蓝色。碳酸钡、硫酸钡都是白色沉淀,硫酸钡还不溶于稀硝酸。
[设计方案]请你帮助小红完成实验报告
实验方法 | 观察到的现象 | 实验结论 |
把少量的“蓝色水”注入试管中,插入一根光亮的铁丝。 | 铁丝表面变成___ 色 | 溶质中含有铜离子 |
把少量的“蓝色水”注入试管中,滴入硝酸钡溶液和稀硝酸 | 白色沉淀 | 溶质中含有的阴离子是__________。 |
[结论与应用]“蓝色水”中溶质的化学式是__________。该物质可以做过氧化氢溶液制氧气反应催化剂,写出此反应的化学方程式_____________________________。
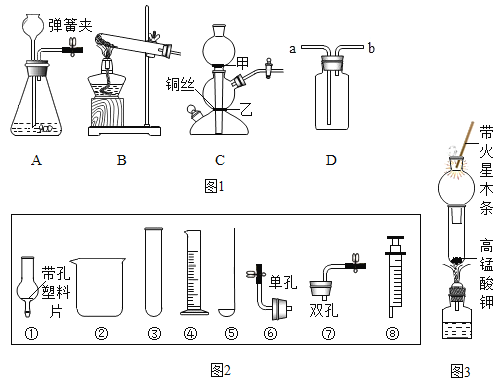
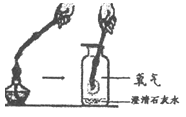
【题目】根据下图所示装置回答问题:
A. 用高锰酸钾制取氧气 | B. 用过氧化氢和二氧化锰制取氧气 |
|
|
(1)实验室用此方法制取氧气的反应文字表达式为_________________。 (2)用此装置收集氧气,利用了氧气的性质是__________________。 (3)当观察到导管口气泡_________地放出时,再把导管口伸入盛满水的集气瓶中,可收集到较纯的氧气。 | (4)仪器a的名称是_______________。 (5)用此装置收集氧气时,检验氧气已经收集满的方法是__________________。 |
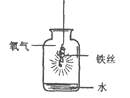
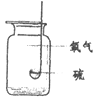
(6)某同学利用A装置收集了三瓶氧气,接着做氧气性质实验。
实验操作示意图 | 实验现象 | |
| 集气瓶中,木炭剧烈燃烧,放出大量的热,①__________________。 | |
| 铁丝剧烈燃烧,放出大量的热,②_________。 | 铁丝在氧气中反应的文字表达式为③_________; 集气瓶中水的作用是④__________________。 |
| 硫剧烈燃烧,放出大量的热,⑤_________。 |