题目内容
【题目】在一密闭容器内加入甲、乙、并、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如下图,下列说法不正确的是( )

A. X的值为4 B. 参加反应的甲、丁质量比为2:1
C. 该反应为分解反应 D. 丙可能为该反应的催化剂
【答案】B
【解析】根据质量守恒定律和题中信息知,乙→甲+丁。A、X的值为4,x 可能是催化剂,故A正确;B、参加反应的甲、丁质量比为3∶6=1:2,故B错误;C、该反应为分解反应,一种物质分解生成两种物质,属于分解反应,故C正确;D、丙可能为该反应的催化剂,反应前后质量没有变化,故D正确。
点睛∶任何一个化学反应都必然遵循质量守恒定律。催化剂在化学反应里能改变反应物化学反应速率(提高或降低),且本身的质量和化学性质在化学反应前后都没有发生改变。

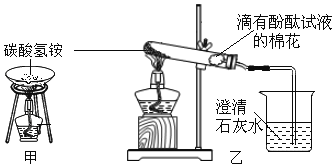
【题目】一氧化碳还原氧化铁
【查阅资料】
1. 氢氧化钙溶液能吸收二氧化碳;
2. 一氧化碳还原氧化铁是逐步失去氧元素的过程。
铁及铁的氧化物 | Fe | FeO | Fe2O3 | Fe3O4 |
颜色 | 黑色 | 黑色 | 红棕色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【实验探究】兴趣小组设计了如图实验装置进行实验。
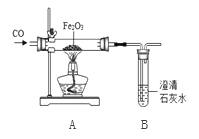
将24.0g氧化铁粉末放入玻璃管中,反应一段时间后,得到黑色固体粉末,并能全被磁铁吸引。兴趣小组猜想黑色粉末可能是(1)铁粉;(2)四氧化三铁;(3)你的猜想是________。
反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应一段时间后 | |
Ⅰ 组 | 玻璃管和红色粉末的总质量为44.0 g | 玻璃管和固体物质的总质量为43.2g |
Ⅱ 组 | 试管和所盛溶液的总质量为30.0 g | 洗气瓶和瓶中物质 的总质量为32.1g |
【交流讨论】
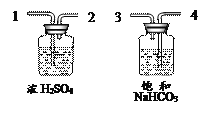
(1)在装置A中先通CO气体的作用是__________。
(2)应该选择________组的实验数据计算来确定黑色粉末的成分,不选择另一组的理由是______。
最终计算结果表明:黑色粉末是__________,请写出该变化的化学方程式_______________。
【题目】蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如图所示:
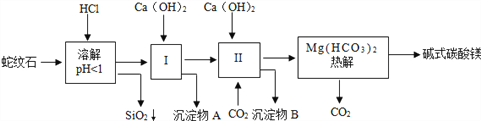
查阅资料:A.几种物质沉淀和溶解时的 pH 如下表
氢氧化物 | 溶液 pH | |||
开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
Fe(OH)3 | 2.3 | 3.4 | 沉淀不溶 | 沉淀不溶 |
Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
Mg(OH)2 | 8.6 | 11.1 | 沉淀不溶 | 沉淀不溶 |
B.难溶性碱加热会生成两种氧化物,各元素化合价都不变。
探究一:制取碱式碳酸镁
(1)在操作Ⅰ中发生的中和反应是________(用化学方程式表示)。
(2)进行操作Ⅰ时,需控制溶液pH=6~7,Ca(OH)2不能过量。若Ca(OH)2过量, 可能导致_______溶解、________沉淀。
(3)从沉淀混合物 A 中提取红色氧化物作颜料,先向沉淀物 A 中加入________(填物质的化学式),然后_________、________、灼烧(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是______。
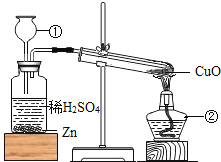
探究二:确定产品碱式碳酸镁(mMgCO3·nMg(OH)2·xH2O)的组成,组装如图 1 仪器:
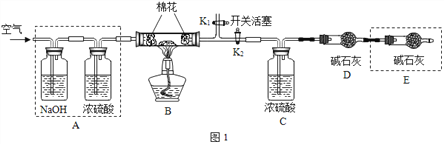
实验测得:硬质玻璃管中剩余的固体质量为 2.0g,C 处浓H2SO4增重 0.9g,D 处碱石灰增 重 1.76g。
(1)在装好试剂后,加热前应进行的操作是_______;
(2)A 框中装置的作用是________;
(3)通过计算写出碱式碳酸镁的化学式__________。(请写出计算过程)
【交流与反思】
(1)若将 E 框中的装置去掉,对实验结果的影响是 m
(2)已知碳酸镁和氢氧化镁在不同的温度下受热易分解为氧化物。为精确测定此碱式碳酸镁受热分解过程中时间与剩余固体质量的关系,结合以上数据,作出图 2 坐标系,试回答。
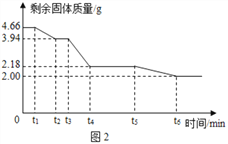
①t4~t5时间段固体的化学式为__________;
②t5~t6时间段发生反应的方程式为___________。