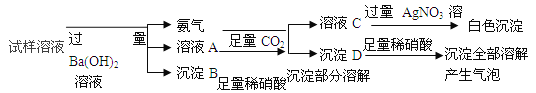
题目内容
【题目】一氧化碳还原氧化铁
【查阅资料】
1. 氢氧化钙溶液能吸收二氧化碳;
2. 一氧化碳还原氧化铁是逐步失去氧元素的过程。
铁及铁的氧化物 | Fe | FeO | Fe2O3 | Fe3O4 |
颜色 | 黑色 | 黑色 | 红棕色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【实验探究】兴趣小组设计了如图实验装置进行实验。
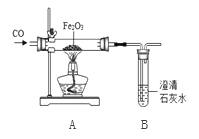
将24.0g氧化铁粉末放入玻璃管中,反应一段时间后,得到黑色固体粉末,并能全被磁铁吸引。兴趣小组猜想黑色粉末可能是(1)铁粉;(2)四氧化三铁;(3)你的猜想是________。
反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应一段时间后 | |
Ⅰ 组 | 玻璃管和红色粉末的总质量为44.0 g | 玻璃管和固体物质的总质量为43.2g |
Ⅱ 组 | 试管和所盛溶液的总质量为30.0 g | 洗气瓶和瓶中物质 的总质量为32.1g |
【交流讨论】
(1)在装置A中先通CO气体的作用是__________。
(2)应该选择________组的实验数据计算来确定黑色粉末的成分,不选择另一组的理由是______。
最终计算结果表明:黑色粉末是__________,请写出该变化的化学方程式_______________。
【答案】 铁粉和四氧化三铁 排尽管中的空气 Ⅰ CO跑出时带有一定水分 四氧化三铁 3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
【解析】本题考查了工业炼铁原理的实验,在分析反应产物时根据质量守恒定律进行分析。
实验探究:黑色固体粉末可能是一种物质,也可能是两种物质的混合物,所以猜想是Fe和Fe3O4的混合物;
交流讨论:(1)一氧化碳和空气的混合物,点燃或受热时可能发生爆炸,加热前应先通CO一会,其作用是排尽装置内空气,避免爆炸;
(2)应该选择Ⅰ组的实验数据计算来确定黑色粉末的成分,不选择另一组的理由是CO跑出时带有一定水分;一氧化碳与氧化铁的反应实质是一氧化碳夺取了氧化铁中氧元素,玻璃管和红色粉末的总质量减少了44g-43.2g=0.8g,24g的氧化铁中含铁元素的质量为24g×![]() ×100%=16.8g,氧元素的质量为24g-16.8g=7.2g, 根据质量守恒定律可知黑色固体中铁元素的质量为16.8g,氧元素的质量=7.2g-0.8g=6.4g,铁元素与氧元素的质量比为 16.8g:6.4g=21:8,四氧化三铁中铁元素与氧元素的质量比=56×3:16×4=21:8,所以反应生成的黑色固体为四氧化三铁,反应的化学方程式是:3Fe2O3+CO
×100%=16.8g,氧元素的质量为24g-16.8g=7.2g, 根据质量守恒定律可知黑色固体中铁元素的质量为16.8g,氧元素的质量=7.2g-0.8g=6.4g,铁元素与氧元素的质量比为 16.8g:6.4g=21:8,四氧化三铁中铁元素与氧元素的质量比=56×3:16×4=21:8,所以反应生成的黑色固体为四氧化三铁,反应的化学方程式是:3Fe2O3+CO ![]() 2Fe3O4+CO2。
2Fe3O4+CO2。

【题目】在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质且如下表.下列说法正确的是
物质 | X | O2 | CO2 | H20 |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待侧 | 28 | 20 |
A. 表中的待测值为32 B. X中一定含有C、H、O元素
C. 该反应是置换反应 D. 反应中CO2和H2O的质量比为11:9
【题目】已知常温下NaOH、Na2CO3、NaCL分别在乙醇中的溶解度(S/g)如下表所示:
在教师的指导下,小明同学进行了如图所示的实验,该装置气密性良好,装置乙中的小纸条为湿润蓝色石蕊试纸。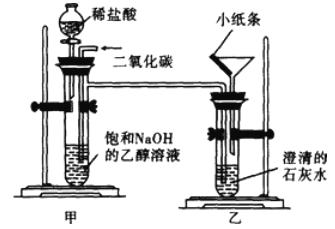
NaOH | Na2CO3 | NaCl |
17.3 | <0.01 | 0.1 |
I.将CO2通入饱和NaOH的乙醇溶液中,装置甲的试管中产生沉淀物;
II.打开分液漏斗活塞,让稀盐酸缓缓滴入装置甲的试管中;
关于该实验有下列说法:
①饱和NaOH的乙醇溶液中溶质是乙醇
②装置甲的试管中产生的沉淀物为碳酸钠
③装置甲的试管中产生的沉淀物为碳酸钙
④步骤II可观察到装置甲的试管中有气泡冒出
⑤实验过程中可观察到装置乙的试管中有沉淀产生
⑥步骤II装置乙中的小纸条变紫色
⑦该实验能验证二氧化碳与氢氧化钠的反应以上说法正确的是
A. ①②④⑤ B. ①③⑤⑥ C. ②④⑤⑦ D. ④⑤⑥⑦