题目内容
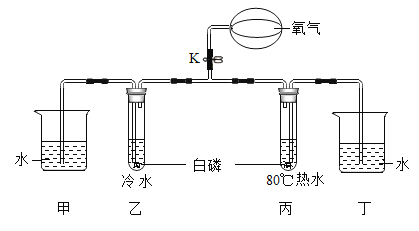
【题目】下图是制取氢气,并还原氧化铜的实验装置(浓硫酸具有吸水性)。
(1)仪器①的名称是______________;仪器②的名称是________________;
(2)写出图中制取氢气的化学反应方程式_________________。
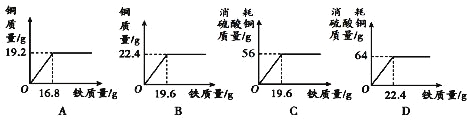
(3)实验时C装置部分是先____________(选填:“通氢气”“加热”),原因是________。化学兴趣小组为了测定黄铜(铜和锌的合金:Cu-Zn)样品中铜的质量分数,取2.0g黄铜加入到足量稀硫酸中,充分反应后,最后测得生成氢气的质量0.04g。通过计算求出该黄铜样品中铜的质量分数_____________。
【答案】 长颈漏斗 酒精灯 Zn+H2SO4==ZnSO4+H2 ↑ 通氢气 排尽装置中的空气防止加热混合气体引起爆炸 35%
【解析】本题考查了制取氢气,并还原氧化铜的实验。
(1)仪器①的名称是长颈漏斗;仪器②的名称是酒精灯;
(2)制取氢气是用锌与稀硫酸反应生成硫酸锌和氢气,化学反应方程式Zn+H2SO4==ZnSO4+H2 ↑;
(3)实验时C装置部分是先通氢气,原因是排尽装置中的空气防止加热混合气体引起爆炸;
设:产生0.04g的氢气需锌的质量为x
Zn+H2SO4==ZnSO4+H2 ↑
65 2
X 0.04g
![]() x=1.3g
x=1.3g
黄铜样品中铜的质量分数=![]() ×100%=35%。
×100%=35%。

 阅读快车系列答案
阅读快车系列答案【题目】过碳酸钠(化学式为2Na2CO33H2O2)俗名固体双氧水。溶于水可看作是Na2CO3溶液和H2O2溶液混合。为了方便保存,过碳酸钠样品可能添加少量的MgSO4和硅酸镁中的一种或二种作为稳定剂。已知①双氧水可用于供氧、消毒和漂白;②硅酸镁不溶于水。
(1)过碳酸钠的用途不合理的是 。
A.鱼池供氧剂 B.消毒剂 C.干燥剂 D.漂白剂
(2)取少量过碳酸钠样品于烧杯中,加入足量蒸馏水,有不溶于水的固体产生。判断样品中 有硅酸镁。(填写“可能”或“一定”)
(3)利用实验室限选试剂,设计实验确定该样品中是否添加少量的MgSO4。
限选试剂:稀盐酸、稀H2SO4、BaCl2溶液、蒸馏水、AgN03溶液
实验操作 | 预期现象和必要结论 |
步骤:1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤。 |
|
步骤2:取少量步骤1所得的滤液于试管中,加入 ,振荡后静置。 | |
步骤3:取少量步骤2所得的溶液于试管中, 。 | ,说明样品中有MgSO4。 ,说明样品中没有MgSO4。 |