题目内容
(7分)兴趣小组的同学为测定某一铁铜合金中含铁的质量分数,将6g该合金粉末样品,加入溶质质量分数为10%的硫酸铜溶液160g中,二者恰好完全反应。同时为了充分利用资源,还对反应后的物质进行回收处理。请结合下列图示计算:
(1)该合金样品中含铁的质量分数;(计算结果精确至0.1%)
(2)所的固体铜的质量a为多少g?
(3)向不饱和滤液中加入多少g水,能得到5%的硫酸亚铁溶液,用于花卉的营养液。
((2)(3)中计算结果精确至0.1g)
(1)93,3%(2)6.8 g(3)144.8g
解析试题分析:根据题意可知,题目中的反应为铁和硫酸铜溶液反应生成铜和硫酸亚铁。(1)已知量为硫酸铜的质量,未知量为铁的质量分数。解题思路:可根据反应的化学方程式中硫酸铜与铁的质量关系求出铁的质量,再求出铁的质量分数;(2)可根据样品总质量及(1)中求出的铁的质量求出原样品中含铜的质量;再根据化学方程式求出生成铜的质量;二者的和即为得到的铜固体的质量。(3)可先根据化学方程式中硫酸铜与硫酸亚铁的质量关系求出生成硫酸亚铁的质量,再根据溶液稀释时溶质的质量不变求出加水的质量。具体过程如下:
(1)解:加入的硫酸铜的质量为:160g×10%=16g
设含铁的质量为x,生成硫酸亚铁的质量为y;生成铜的质量为z;则
Fe+CuSO4==FeSO4+Cu
56 160 152 64
x 16g y z
56:160=x:16g
x=5.6g
160:152= 16g:y
y="15." 2 g
160:64= 16g:z
z="6." 4 g
样品中铁的质量分数为: ×100%=93,3%
×100%=93,3%
(2)铜的质量为a=(6g —5.6g)+6. 4 g="6.8" g
(3)加入水的质量为15. 2 g÷5%—(160g+6g—6.8 g)=144.8g
考点:综合计算

某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下:
| 实验次数 | 1 | 2 | 3 |
| 盐酸质量 | 5g | 5g | 5g |
| 氢气质量 | 0.04g | m | 0.02g |
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
(5分)哈南新城在地铁建设中需要大量的钢铁,现有赤铁矿样品(所含杂质不溶于水也不与酸反应),实验小组同学为测定其纯度,
进行了三次实验,实验数据如下表所示。请回答下列问题:
| | 第1次 | 第2次 | 第3次 |
| 样品质量(g) | 25 | 30 | 25 |
| 盐酸质量(g) | 200 | 100 | 100 |
| 所得溶液质量(g) | 216 | 116 | 116 |
(2)列出第2次参加反应的盐酸中溶质质量(X)的比例式 ;
(3)向恰好完全反应后的溶液中加入46.5g水,则最终所得的溶液中溶质的质量分数为 ;
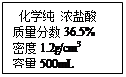
(4)若用上述标签所示的浓盐酸配制三次实验中所需的盐酸,需量取浓盐酸的体积
为 mL;
(5)用500t该矿石可制得含杂质的铁的质量为 。


