题目内容
某工业盐酸中因含有少量FeCl3(不含其它杂质)而显黄色,测知该盐酸中H+和Cl﹣的个数比为88:97,则其中Fe3+和Cl﹣的个数比为( )
| A.1:97 | B.1:3 | C.3:1 | D.3:97 |
D
解析试题分析:H+与Cl﹣的个数比为88:97,则负电荷总数为97,氢离子所带正电荷总数为88,要保证阴离子所带负电荷数值与阳离子所带正电荷数值相等,则铁离子需要提供9个正电荷,一个铁离子带三个正电荷,故铁离子个数为3,所以Fe3+与Cl﹣的个数比为3:97,观察选项,故选D.
考点:分子、原子、离子、元素与物质之间的关系.
点评:本题考查了溶液中离子个数比的计算,完成此题,可以依据阴离子所带负电荷总数与阳离子所带正电荷数值相等进行.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案将一瓶盐酸分别倒入两只大烧杯中,将烧杯放在天平两边,并调节天平到指针指在分度盘中间,然后在左盘的烧杯中加10g碳酸钙,在右盘的烧杯中加入10g碳酸钠,待烧杯中固体物质完全消失后,天平指针( )
| A.仍在中间 | B.偏向左盘 | C.偏向右盘 | D.无法确定 |
某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下:
| 实验次数 | 1 | 2 | 3 |
| 盐酸质量 | 5g | 5g | 5g |
| 氢气质量 | 0.04g | m | 0.02g |
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
在天平两边各放一只盛有等质量的相同溶质质量分数的稀硫酸的烧杯,把天平调至平衡,然后在左边烧杯中放入3.3克铝粉,为使天平平衡,向右边的烧杯中应加入镁粉的质量可能是( )
| A.6.6克 | B.3.3克 | C.3.2克 | D.2.4克 |
我国青海湖采集的天然碱样品可表示为aNa2CO3·bNaHCO3·cH2O(a、b、c为最简整数比)。小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验: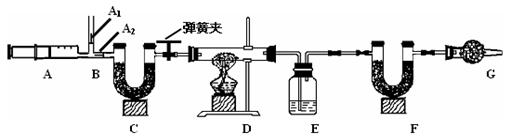
已知:1.碳酸钠比较稳定,加热时不分解 ;2. 2NaHCO3 Na2CO3 +CO2 ↑ +H2O
Na2CO3 +CO2 ↑ +H2O
3.图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭。
实验步骤
实验时,组装好装置,实验前应先 ,然后,实验步骤是:
① 反复推拉注射器 ② 称量E、F的质量 ③ 关闭弹簧夹,加热D处试管直到反
应不再进行 ④ 打开弹簧夹,再次反复缓缓推拉注射器 ⑤ 再次称量E、F的质量。
(二)问题探究:
(2) E中的药品为 ,E的作用是 。C、F、G中装有碱石灰(生石灰与烧碱的固体混合物),则C的作用是 , F的作用是 。写出 F装置中所发生反应的一个化学方程式 。
(3)实验步骤②与③能否颠倒 (填“能”或“不能”)。若不进行步骤④的操作,则所测得的碳酸氢钠质量 (填“偏大”、“偏小”、“无影响”), 该操作中推注射器时缓缓的目的是 ;若没有G装置,则碳酸氢钠的质量 (填“偏大”、“偏小”、“无影响”)。
(4)下表是实验记录数据:
| 反应前 | 反应后 |
| E的质量为100.0g | E的质量为102.25g |
| F的质量为50.0g | F的质量为51.1g |
② 碳酸氢钠的质量为 g
③ 该天然碱的化学式中a:b:c= 。


