题目内容
在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜。
(1)请完成该反应的化学方程式:
2Cu+2H2SO4+O2 2CuSO4+
2CuSO4+
(2)利用此反应,将含铜80%的废料与10%的稀硫酸反应转化为10%的硫酸铜溶液,计算要得到1600g10%的硫酸铜溶液,需要加入稀硫酸的质量和水的质量(假设杂质不参加反应,也不溶于水)。
(1)请完成该反应的化学方程式:
2Cu+2H2SO4+O2
 2CuSO4+
2CuSO4+ (2)利用此反应,将含铜80%的废料与10%的稀硫酸反应转化为10%的硫酸铜溶液,计算要得到1600g10%的硫酸铜溶液,需要加入稀硫酸的质量和水的质量(假设杂质不参加反应,也不溶于水)。
(1)2H2O (2)980g 540g
试题分析:(1)由反应的化学方程式2Cu+2H2SO4+O2
 2CuSO4+ 可知,
2CuSO4+ 可知,反应前 反应后
Cu原子 2 2
H原子 4 0
S原子 2 2
O原子 10 8
根据质量守恒定律,化学变化前后原子的种类、数目不变,可判断另一未知生成物的分子中含有4个H原子和2个O原子,则该物质为水,短线上的化学式为2H2O。
(2)根据题给的生成的硫酸铜的质量,结合化学方程式中有关物质间的质量比,可计算出参加反应的稀硫酸中溶质的质量,以及生成水的质量,进而求出稀硫酸的质量。
解:1600g10%的硫酸铜溶液中含有硫酸铜的质量=1600g×10%=160g。
设消耗H2SO4的质量为x,生成水的质量y
2Cu + 2H2SO4 + O2= 2CuSO4 + 2H2O
196 320 36
x 160g y
 =
=
解得,x=98g
 =
=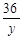
解得,y=18g
则稀硫酸溶液的质量=98g÷10%=980g
则加入水的质量=1600g-160g-18g-980g×(1-10%)=540g。
答:需要加入稀硫酸的质量为980g,加入水的质量为540g。
点评:利用质量守恒定律中的原子守恒来推断物质的化学式,是解此类题最常用的方法,学生应注意守恒思想在解题中的重要作用;根据化学方程式进行的计算,难度不大,解答时注意要有完整的计算步骤和规范的书写格式即可,此外还要明确溶液的质量=溶质的质量+溶剂的质量,这也是解答本题的关键之一。

练习册系列答案
相关题目

 .试求:
.试求: ;现有680 Kg四氯化硅(SiCl4)与足量的氢气反应,理论上可以制的高纯硅(Si)的质量为多少?
;现有680 Kg四氯化硅(SiCl4)与足量的氢气反应,理论上可以制的高纯硅(Si)的质量为多少? 2AlN。若有54 kg高纯度铝粉,求可制得氮化铝的质量。
2AlN。若有54 kg高纯度铝粉,求可制得氮化铝的质量。