题目内容
(3分)王老师要用含杂质质量分数为20%的大理石与足量的稀盐酸反应,制备10瓶二氧化碳气体。已知:①集气瓶的体积为100 mL;②大理石中杂质不与稀盐酸反应;③常温常压下二氧化碳的密度为1.98 g/L。
计算李王师需要准备大理石的最少质量。
计算李王师需要准备大理石的最少质量。
5.625g
试题分析:根据二氧化碳的体积和密度计算出二氧化碳的质量,再根据化学方程式中二氧化碳与碳酸钙的质量比,计算出碳酸钙的质量,再除以大理石中碳酸钙的质量分数即可求出大理石的质量。
解:反应生成的CO2质量=10×100ml×10-3L/ml×1.98g/L=1.98g
设参加反应的CaCO3质量为x
CaCO3 + 2HCl ="===" CaCl2 + CO2↑ + H2O
100 44
x 1.98 g
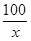 =
= 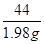
解得,x=4.5g
则需要准备大理石质量=4.5g÷(1-20%)=5.625g
答:需要准备大理石的最少质量为5.625g。
点评:解答本题的关键是要根据二氧化碳的体积和密度计算出质量,要注意体积、密度、质量的关系,还需要注意含杂质的质量。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 .试求:
.试求: ;现有680 Kg四氯化硅(SiCl4)与足量的氢气反应,理论上可以制的高纯硅(Si)的质量为多少?
;现有680 Kg四氯化硅(SiCl4)与足量的氢气反应,理论上可以制的高纯硅(Si)的质量为多少? K2S + 3CO2↑+ N2↑。若该反应消耗64 g硫,计算生成CO2的质量。
K2S + 3CO2↑+ N2↑。若该反应消耗64 g硫,计算生成CO2的质量。 2AlN。若有54 kg高纯度铝粉,求可制得氮化铝的质量。
2AlN。若有54 kg高纯度铝粉,求可制得氮化铝的质量。