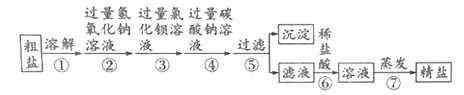
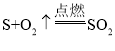
题目内容
【题目】现有一包白色固体可能含有CaO、CuSO4、 K2SO4、BaCl2、 K2CO3中的一种或几种。为确定其成分,进行如下实验:
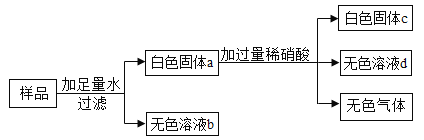
(1)上述实验过程中,产生的无色气体是__________________;
(2)原白色固体中可能有CaO,检验是否有CaO的操作是:取少量无色溶液b,______________;经检验原白色固体中确实不含有CaO;
(3)无色溶液b中溶质有______________种可能;
(4)下列设想合理的是______________;
A 用白色固体a除去氯化钡中少量的盐酸
B 用无色溶液d鉴别氢氧化钠溶液和碳酸钠溶液
C 在无色溶液b中,加适量的氯化钡溶液可制得纯净的氯化钾
【答案】二氧化碳 滴加足量的氯化钙,后滴加酚酞试液 5 AB
【解析】
硫酸铜溶液是蓝色的,氧化钙和水反应生成氢氧化钙;硫酸钾和氯化钡反应生成硫酸钡沉淀和氯化钾,碳酸钾和氯化钡反应生成碳酸钡沉淀和氯化钾;硫酸钡不能和稀硝酸反应,碳酸钡和稀硝酸反应生成硝酸钡、水和二氧化碳;
向样品中加入足量水后,得到无色溶液,说明样品中不含有硫酸铜,加入过量稀硝酸后,仍然含有白色沉淀,说明沉淀c是硫酸钡,进一步说明样品中含有硫酸钾和氯化钡,得到的无色气体是二氧化碳,说明沉淀中含有碳酸钡,进一步说明样品中含有碳酸钾;
(1)上述实验过程中,产生的无色气体是二氧化碳。
(2)原白色固体中可能有CaO的操作是:取少量无色溶液b于试管中,先滴加过量的氯化钙(氯化钡等,合理即可)溶液,然后再滴加酚酞试液,酚酞试液不变色,说明原白色固体中确实不含有CaO。
(3)无色溶液b中溶质可能是:如果氯化钡过量,则溶质是氯化钾和氯化钡;
如果硫酸钾过量,则溶质是氯化钾和硫酸钾;
如果碳酸钾过量,则溶质是氯化钾和碳酸钾;
如果硫酸钾和碳酸钾都过量,则溶质是氯化钾、硫酸钾和碳酸钾;
如果氯化钡、碳酸钾、硫酸钾之间恰好完全反应,则溶质是氯化钾,因此无色溶液b中溶质有5种可能。
(4)A、白色固体a中含有碳酸钡和硫酸钡,加入到含有少量盐酸的氯化钡溶液中时,其中的碳酸钡能和稀盐酸反应,从而除去稀盐酸,符合题意;
B、无色溶液d中含有稀硝酸,分别滴加到氢氧化钠溶液和碳酸钠溶液中时,能够产生气泡的溶液是碳酸钠溶液,无明显现象的是氢氧化钠溶液,符合题意;
C、在无色溶液b中,如果氯化钡过量,则溶质是氯化钾和氯化钡,加适量的氯化钡溶液不能制得纯净的氯化钾,不符合题意。故选AB。

 备战中考寒假系列答案
备战中考寒假系列答案