题目内容
【题目】甲乙两同学在学习酸的化学性质时做了如图所示实验:
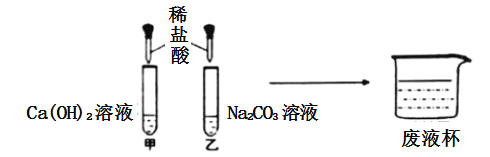
甲同学实验时没有观察到明显现象,乙同学实验时观察到有气泡产生:甲乙同学将反应完成后试管中的溶液倒入一洁净的废液杯中,没有观察到明显现象.
【提出问题】废液杯中溶液的溶质是什么?
【猜想与假设】猜想1:废液中含有的溶质为NaCl、CaCl2
猜想2:废液中含有的溶质为NaCl、CaCl2、HCl
猜想3:废液中含有的溶质为__________(写化学式)
【验证与探究】甲同学取少量废液于试管中,加入紫色石蕊试液,溶液变红,则猜想_____
正确;乙同学取少量的废液于试管中,加入适量氧化铁粉末,发现溶液变黄色,发生反应的化学方程式为_______________________________________________.
【表达与交流】甲乙同学都认为将该溶液直接排放会对环境造成危害,你认为处理该废液的最佳方法是________________________________________________.
【归纳与总结】确定反应后溶液中溶质的成分,除了要考虑生成物外,还要考虑__________.
【答案】 NaCl、CaCl2、Ca(OH)2 2 Fe2O3+6HCl=2FeCl3+3H2O 加熟石灰中和至中性 生成物是否有剩余
【解析】本题通过化学反应后的溶液成分,考查了酸、碱和盐的化学性质。在猜想反应后溶液成分时,除了有反应生成的物质,还要考虑反应物过量问题。
猜想与假设:甲中氢氧化钙和盐酸反应生成氯化钙和水,乙中盐酸和碳酸钠生成氯化钠和水和二氧化碳,甲乙同学将反应完成后试管中的溶液倒入,洁净的废液杯中,没有观察到明显现象,说明液体中没有碳酸根,反应后溶液中可能存在过量的盐酸或氢氧化钙。因此:
猜想1:废液中含有的溶质为NaCl、CaCl2;
猜想2:废液中含有的溶质为NaCl、CaCl2、HCl;
猜想3:废液中含有的溶质为NaCl、CaCl2、Ca(OH)2;
验证与探究:紫色石蕊试液遇酸性溶液变红。甲同学取少量废液于试管中,加入紫色石蕊试液,溶液变红,说明溶液呈酸性,则猜想2正确;氧化铁与盐酸发生复分解反应生成氯化铁和水。乙同学取少量的废液于试管中,加入适量氧化铁粉末,发现溶液变黄色,发生反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O;
表达与交流:经验证猜想2正确,废液中含有盐酸,盐酸能与氢氧化钙发生中和反应。实验室的废液未经处理直接排放会污染环境,可利用加熟石灰中和至中性;

 阅读快车系列答案
阅读快车系列答案