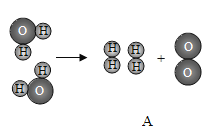
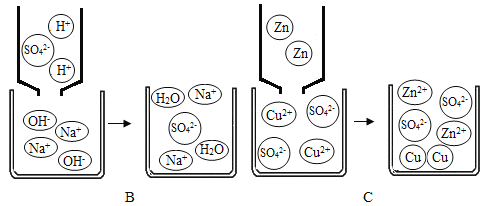
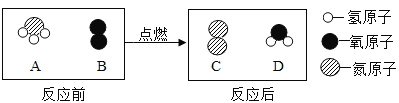
题目内容
【题目】在学习金属活动性顺序时,老师说:“排在前面的金属能将后面的金属从他们的盐溶液中置换出来,但是K、Ca、Na除外,因为K、Ca、Na能与溶液中的水发生反应”。对这个问题,课外小组的同学很感兴趣,展开了金属与水反应的探究。
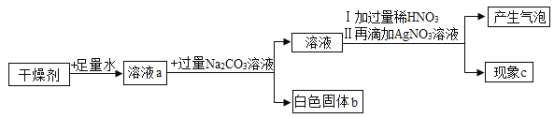
探究I: 探究钠、镁能否与水反应
分别将等质量的镁条打磨干净投入25oC和100oC的沸水中,观察记录实验现象:
实验序号 | ① | ② | ③ |
实验装置 |
|
|
|
实验 现象 | 钠浮在水面上,不断跳动,很快收集到一试管气体,金属钠最后消失 | 有细小气泡,镁条逐渐变灰黑色,10分钟后无明显变化 | 有较大气泡冒出,镁条逐渐变灰黑。约5分钟后,无明显现象 |
向烧杯中滴加酚酞,变红 | 收集约5mL气体,取出试管,将燃着的木条伸入试管中,有尖锐的爆鸣声 |
发现问题:镁条为什么不能持续冒出气泡。
查阅资料: Mg(OH)2难溶于水;NH4+和HCO3-可以加快Mg与水反应。
探究II:探究NH4+和HCO3-对Mg与水反应是否有促进作用
用探究I与水反应后的Mg条与4种盐溶液进行对比实验,结果如下。
实验序号 | a | b | c | d |
盐溶液(浓度相同) | NH4Cl | NaHCO3 | NaCl | NH4HCO3 |
5.1 | 8.3 | 7 | 7.8 | |
30min时产生气体体积(mL) | 1.5 | 0.7 | <0.1 | 1.4 |
气体的主要成分 | H2 | |||
30min时镁条表面情况 | 大量固体附着(固体可溶于盐酸) | |||
根据以上探究回答下列问题:
(1)钠与水反应后的液体显__________(填“酸性”、“碱性”、“中性”)。
(2)由探究I推出钠具有的一条物理性质是__________。
(3)证明镁条能与水发生反应的证据是__________。
(4)通过以上探究得出Mg与水反应的化学方程式为__________。
(5探究II中能够说明HCO3-对Mg与水反应起促进作用的证据是_________。
(6)分析探究全过程,得出影响金属与水反应速率的因素有__________(至少答两点)。
【答案】碱性 钠的密度比水小 用燃着的木条点燃镁与水产生的气体,有尖锐的爆鸣声 Mg+2H2O=Mg(OH)2+H2↑ 实验b和实验c对比,相同时间内b收集到的气体比c多 金属的活动性、温度等
【解析】
(1)钠与水反应后,向溶液中滴加酚酞,观察到溶液变红,则证明溶液显碱性,是无色酚酞试液变红。故答案为:碱性;
(2)根据实验Ⅰ可知,钠块浮在水面上,则证明金属钠的密度小于水。故答案为:钠的密度比水小;
(3)镁和水反应有大量的气泡冒出。收集到该部分气体后,将燃着的小木条伸入试管中,有尖锐的爆鸣声,则可以推测该气体是氢气。而镁、水中均不含有氢气,则证明镁和水发生了化学反应,生成了氢气。故答案为:用燃着的木条点燃镁与水产生的气体,有尖锐的爆鸣声;
(4)根据探究Ⅰ可知,钠与水反应生成了一种碱性物质,镁与水反应生成了氢气,则可以推测出,金属镁和水反应生成了氢气和一种碱性物质。这种碱性物质可能是金属对应的碱,则镁和水反应生成氢氧化镁和氢气。故答案为:Mg+2H2O=Mg(OH)2+H2↑;
(5)实验探究Ⅱ中,实验b是NaHCO3,在水溶液中能电离出Na+和HCO3-。实验c是Na+和Cl-。两组实验中,阳离子相同,但是阴离子不同。则根据两组实验30分钟内产生的气体的体积可知,b组产生的氢气比c组产生的氢气要多,则可以判断出碳酸氢根离子对镁与水的反应起促进作用。故答案为:实验b和实验c对比,相同时间内b收集到的气体比c多;
(6)根据实验Ⅰ的①②可知,相同环境,不同活动性的金属反应的现象也不同。根据实验Ⅰ的②③可知,同种金属,不同温度的金属反应现象也不同。故答案为:金属的活动性、温度等。

 小学同步三练核心密卷系列答案
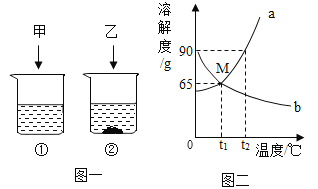
小学同步三练核心密卷系列答案【题目】下表是Na2CO3、NaCl的溶解度。依据表中数据和实验完成下面小题。
温度 | Na2CO3 | NaCl |
20℃ | 21.8g | 36.0g |
30℃ | 39.7g | 36.3g |
20℃时,向2只盛有100g水的烧杯中,分别加入30g两种固体,充分溶解。

【1】上述溶液为饱和溶液的是( )
A.①B.②C.③D.④
【2】下列说法正确的是( )
A.①所得溶液中溶质与溶剂质量比为3:10
B.②所得溶液中溶质的质量分数为30%
C.①和③的溶质质量分数相等
D.③和④的溶质质量分数相等
【题目】请从A~D中任选三个作答。
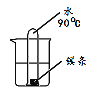
如图所示,在两支试管中进行实验,补全实验方案。
序号 | 目的 | 步骤 |
A | 验证_____ | ①试管1中加入一小块白磷和5mL80℃热水,试管2中加入一小块白磷和5mL冷水;②分别通入氧气 |
B | 鉴别稀硫酸和碳酸钠溶液 | ①试管1、2中分别加入两种待测溶液;②分别加入_____溶液 |
C | 比较铁、铜、银的金属活动性 | ①试管1中加入FeSO4溶液,试管2中加入AgNO3溶液; ②分别插入_____ |
D | 比较_____ | ①试管1中加入一粒高锰酸钾和5mL汽油,试管2中加入一粒碘和5mL汽油;②振荡 |