题目内容
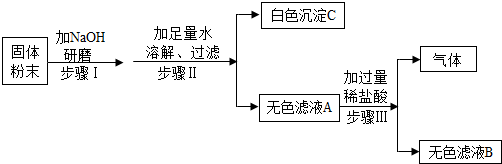
为测定部分变质的烧碱中氢氧化钠的质量分数,称取样品5.3g,加入10%的氯化钡溶液,至沉淀不再产生,洗涤、烘干、称量后得到沉淀0.01mol.
①写出氢氧化钠变质的化学方程式 .
②求样品中氢氧化钠的质量分数.(根据化学方程式计算)
①写出氢氧化钠变质的化学方程式
②求样品中氢氧化钠的质量分数.(根据化学方程式计算)
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:①根据二氧化碳和氢氧化钠反应生成碳酸钠和水进行解答;
②根据碳酸钡沉淀的物质的量和碳酸钠与氯化钡反应的化学方程式,可求得碳酸钠的物质的量;进一步可求得样品中氢氧化钠的质量分数.
②根据碳酸钡沉淀的物质的量和碳酸钠与氯化钡反应的化学方程式,可求得碳酸钠的物质的量;进一步可求得样品中氢氧化钠的质量分数.
解答:解:①二氧化碳和氢氧化钠反应生成碳酸钠和水,化学方程式为2NaOH+CO2=Na2CO3+H2O;故填:2NaOH+CO2=Na2CO3+H2O;
②设样品中碳酸钠的物质的量为x
Na2CO3+BaCl2═BaCO3↓+2NaCl
1 1
x 0.01mol
=
x=0.01mol
样品中氢氧化钠的质量分数为:
×100%═80%
答:样品中氢氧化钠的质量分数为80%
②设样品中碳酸钠的物质的量为x
Na2CO3+BaCl2═BaCO3↓+2NaCl
1 1
x 0.01mol
| 1 |
| x |
| 1 |
| 0.01mol |
x=0.01mol
样品中氢氧化钠的质量分数为:
| 5.3g-0.01mol×106g/mol |
| 5.3g |
答:样品中氢氧化钠的质量分数为80%
点评:本题主要考查学生运用化学方程式和质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目

 小丽利用底部有一个小孔的大试管,如图甲所示配制成一个制取CO2气体的装置.
小丽利用底部有一个小孔的大试管,如图甲所示配制成一个制取CO2气体的装置.