题目内容
某工厂利用菱铁矿(主要成分为FeCO3,其余为SiO2等难溶于酸的杂质,杂质不含铁元素)制备铁红(氧化铁)等产品的实验流程如下:
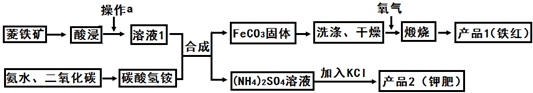
已知几种盐的溶解度随温度变化的曲线如图所示:

回答下列问题:
(1)酸浸得到溶液1时发生反应的方程式为 ;
(2)操作a的名称 ;
(3)检验FeCO3固体是否洗涤干净的操作方法是 ;
(4)产品2的化学式为 ,20℃时它的溶解度为 g
(5)该流程中可循环利用的气态物质是 ;
(6)取该菱铁矿100克,最终得到产品氧化铁质量为40g,则原矿石中碳酸亚铁的质量分数不低于 .(写出计算过程,没有计算过程不给分)

已知几种盐的溶解度随温度变化的曲线如图所示:

回答下列问题:
(1)酸浸得到溶液1时发生反应的方程式为
(2)操作a的名称
(3)检验FeCO3固体是否洗涤干净的操作方法是
(4)产品2的化学式为
(5)该流程中可循环利用的气态物质是
(6)取该菱铁矿100克,最终得到产品氧化铁质量为40g,则原矿石中碳酸亚铁的质量分数不低于
考点:物质的相互转化和制备,酸的化学性质,盐的化学性质,根据化学反应方程式的计算
专题:物质的制备
分析:(1)根据碳酸亚铁与硫酸的反应写出反应的化学方程式;
(2)根据过滤的原理分析回答名称
(3)通过检验硫酸根离子来检验FeCO3固体是否洗涤干净;
(4)根据溶解度分析产品2的名称写出化学式;
(5)根据实验的过程分析可以循环利用的气态物质;
(6)根据元素质量守恒阶段出碳酸亚铁的质量再计算出碳酸亚铁的质量分数.
(2)根据过滤的原理分析回答名称
(3)通过检验硫酸根离子来检验FeCO3固体是否洗涤干净;
(4)根据溶解度分析产品2的名称写出化学式;
(5)根据实验的过程分析可以循环利用的气态物质;
(6)根据元素质量守恒阶段出碳酸亚铁的质量再计算出碳酸亚铁的质量分数.
解答:解:(1)酸浸得到溶液1时发生反应是碳酸亚铁和硫酸反应,方程式为:FeCO3+H2SO4=FeSO4+H2O+CO2↑;
(2)操作a是将固液分开,名称是过滤;
(3)检验FeCO3固体是否洗涤干净的操作方法是:取少量洗涤后的溶液于试管中,滴加盐酸酸化的氯化钡溶液,若无白色沉淀生成,则说明沉淀洗涤干净;
(4)由于硫酸钾的溶解度较小,产品2是硫酸钾,化学式为K2SO4,20℃时它的溶解度为10g.
(5)由实验的过程可知,该流程中可循环利用的气态物质是二氧化碳.
(6)设碳酸亚铁的质量为x
2FeCO3~Fe2O3
232 160
x 40g
=
解得:x=58g
原矿石中碳酸亚铁的质量分数为:
×100%=58%
故答为:(1)FeCO3+H2SO4=FeSO4+H2O+CO2↑;(2)过滤;(3):取少量洗涤后的溶液于试管中,滴加盐酸酸化的氯化钡溶液,若无白色沉淀生成,则说明沉淀洗涤干净;(4)K2SO4,10g;(5)二氧化碳;(6)58%
(2)操作a是将固液分开,名称是过滤;
(3)检验FeCO3固体是否洗涤干净的操作方法是:取少量洗涤后的溶液于试管中,滴加盐酸酸化的氯化钡溶液,若无白色沉淀生成,则说明沉淀洗涤干净;
(4)由于硫酸钾的溶解度较小,产品2是硫酸钾,化学式为K2SO4,20℃时它的溶解度为10g.
(5)由实验的过程可知,该流程中可循环利用的气态物质是二氧化碳.
(6)设碳酸亚铁的质量为x
2FeCO3~Fe2O3
232 160
x 40g
| 232 |
| 160 |
| x |
| 40g |
原矿石中碳酸亚铁的质量分数为:
| 58g |
| 100g |
故答为:(1)FeCO3+H2SO4=FeSO4+H2O+CO2↑;(2)过滤;(3):取少量洗涤后的溶液于试管中,滴加盐酸酸化的氯化钡溶液,若无白色沉淀生成,则说明沉淀洗涤干净;(4)K2SO4,10g;(5)二氧化碳;(6)58%
点评:本题考查物质的制备,侧重于学生的分析能力和实验能力的考查,为中考常见题型和高频考点,注意把握实验的流程和制备原理,难度较大等.

练习册系列答案
相关题目
 有位同学设计了下列实验(装置及所用药品如图所示),仔细观察后回答下列问题.
有位同学设计了下列实验(装置及所用药品如图所示),仔细观察后回答下列问题.
 课外兴趣小组的同学在听过消防知识讲座后,进行了如图所示的实验探究:A、B为两支燃着的蜡烛,当罩上一个大烧杯后,你认为他们能观察到的现象是
课外兴趣小组的同学在听过消防知识讲座后,进行了如图所示的实验探究:A、B为两支燃着的蜡烛,当罩上一个大烧杯后,你认为他们能观察到的现象是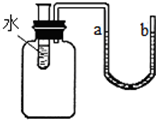 某同学做了一个趣味实验(装置气密性良好).整个实验过程如下:如右图所示装置,向试管里的水中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升.
某同学做了一个趣味实验(装置气密性良好).整个实验过程如下:如右图所示装置,向试管里的水中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升.