题目内容
有一包固体粉末可能由NH4Cl、Na2CO3、BaCl2、CuSO4、Na2SO4中的一种或几种组成.为了确定其组成,某化学兴趣小组做了以下实验:
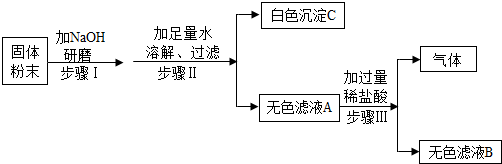
已知,步骤Ⅰ中无明显现象;步骤Ⅱ可观察到有白色沉淀生成;步骤Ⅲ可观察到有气体生成.
请回答下列问题:
(1)这包固体中以定不存在的物质有 ;
(2)写出步骤Ⅱ中一定发生反应的化学方程式 .
(3)步骤Ⅱ所得滤液A中一定含有的溶质是 .
(4)以上步骤完成后,还需补充实验才能确定固体粉末的组成,具体做法是: .

已知,步骤Ⅰ中无明显现象;步骤Ⅱ可观察到有白色沉淀生成;步骤Ⅲ可观察到有气体生成.
请回答下列问题:
(1)这包固体中以定不存在的物质有
(2)写出步骤Ⅱ中一定发生反应的化学方程式
(3)步骤Ⅱ所得滤液A中一定含有的溶质是
(4)以上步骤完成后,还需补充实验才能确定固体粉末的组成,具体做法是:
考点:物质的鉴别、推断,盐的化学性质,铵态氮肥的检验,书写化学方程式、文字表达式、电离方程式
专题:混合物组成的推断题
分析:根据题目给出的信息:取白色粉末加入氢氧化钠混合,研磨,无明显现象,说明一定没有氯化铵;加入足量水中,溶解,得到白色沉淀C和无色滤液A,因此一定没有硫酸铜;向无色滤液中滴加稀盐酸产生气泡,说明一定含有碳酸钠,碳酸钠能够和氯化钡反应产生沉淀,因此粉末中一定含有碳酸钠和氯化钡,不能确定硫酸钠的存在;若证明硫酸钠的存在,可以证明硫酸钡的存在,因此滴加酸,看沉淀溶解情况,得出结论.
解答:解:取取白色粉末加入氢氧化钠混合,研磨,无明显现象,说明一定没有氯化铵;加入足量水中,溶解,得到白色沉淀C和无色滤液A,因此一定没有硫酸铜;向无色滤液中滴加稀盐酸产生气泡,说明一定含有碳酸钠,碳酸钠能够和氯化钡反应产生沉淀,因此粉末中一定含有碳酸钠和氯化钡,不能确定硫酸钠的存在,因此:
(1)这包固体中以定不存在的物质有氯化铵、硫酸铜;
(2)因为一定含有碳酸钠和氯化钡,因此步骤Ⅱ中出现白色沉淀的反应一定有碳酸钠和氯化钡生成碳酸钡沉淀的过程,方程式为:Na2CO3+BaCl2═BaCO3↓+2NaCl;
(3)步骤Ⅱ所得滤液A中一定含有的溶质有:加入未反应的氢氧化钠、碳酸钠和氯化钡反应产生的氯化钠和与盐酸反应产生气泡的碳酸钠;
(4)因为根据现象无法确定硫酸钠的存在,若证明硫酸钠的存在,可以证明硫酸钡的存在,因此滴加酸,看沉淀溶解情况,因此可以向白色沉淀C中滴加稀盐酸,若全部溶解,则只含有碳酸钠、氯化钡;若沉淀部分溶解,则含有碳酸钠、氯化钡和硫酸钠;
故答案为:(1)氯化铵、硫酸铜;(2)Na2CO3+BaCl2═BaCO3↓+2NaCl;(3)氯化钠、碳酸钠和氢氧化钠;(4)向白色沉淀C中滴加稀盐酸,若全部溶解,则只含有碳酸钠、氯化钡;若沉淀部分溶解,则含有碳酸钠、氯化钡和硫酸钠.
(1)这包固体中以定不存在的物质有氯化铵、硫酸铜;
(2)因为一定含有碳酸钠和氯化钡,因此步骤Ⅱ中出现白色沉淀的反应一定有碳酸钠和氯化钡生成碳酸钡沉淀的过程,方程式为:Na2CO3+BaCl2═BaCO3↓+2NaCl;
(3)步骤Ⅱ所得滤液A中一定含有的溶质有:加入未反应的氢氧化钠、碳酸钠和氯化钡反应产生的氯化钠和与盐酸反应产生气泡的碳酸钠;
(4)因为根据现象无法确定硫酸钠的存在,若证明硫酸钠的存在,可以证明硫酸钡的存在,因此滴加酸,看沉淀溶解情况,因此可以向白色沉淀C中滴加稀盐酸,若全部溶解,则只含有碳酸钠、氯化钡;若沉淀部分溶解,则含有碳酸钠、氯化钡和硫酸钠;
故答案为:(1)氯化铵、硫酸铜;(2)Na2CO3+BaCl2═BaCO3↓+2NaCl;(3)氯化钠、碳酸钠和氢氧化钠;(4)向白色沉淀C中滴加稀盐酸,若全部溶解,则只含有碳酸钠、氯化钡;若沉淀部分溶解,则含有碳酸钠、氯化钡和硫酸钠.
点评:本题为框图式物质推断题,在解此类题时,首先可以依据题干提供的信息结合所给混合物中各物质的性质,然后根据题中所给的实验现象进行判断各种物质的存在性,最后确定混合物的组成成分.

练习册系列答案
相关题目
 如图是一氧化碳还原氧化铜的实验装置,根据实验事实填空.
如图是一氧化碳还原氧化铜的实验装置,根据实验事实填空. 有位同学设计了下列实验(装置及所用药品如图所示),仔细观察后回答下列问题.
有位同学设计了下列实验(装置及所用药品如图所示),仔细观察后回答下列问题.

 课外兴趣小组的同学在听过消防知识讲座后,进行了如图所示的实验探究:A、B为两支燃着的蜡烛,当罩上一个大烧杯后,你认为他们能观察到的现象是
课外兴趣小组的同学在听过消防知识讲座后,进行了如图所示的实验探究:A、B为两支燃着的蜡烛,当罩上一个大烧杯后,你认为他们能观察到的现象是
