题目内容
【题目】物质除杂是化学实验中经常遇到的问题。
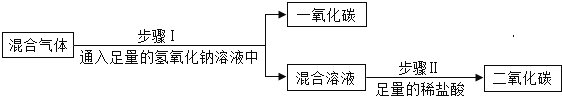
实验一:为除去二氧化碳气体中混有的少量一氧化碳,小明设计了三种方案。
实验方案 | |
方案 A |
|
方案 B |
|
方案 C |
|
上述方案中有两个方案是合理的,他们是___________写出合理方案中任意一个反应的化学方程式 ____________。
实验二:由于粗盐中含有少量 MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图:
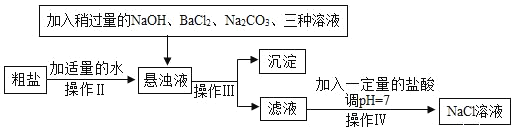
(1)加入稍过量的 Na2CO3溶液除了能除去粗盐中的 CaCl2外,它还有一个作用是 _____________(用化学方程式表示)
(2)实验操作Ⅲ是_____________,要用到的实验玻璃仪器是玻璃棒、漏斗和 ________________。
(3)如果稍过量的试剂加入的顺序依次为:Na2CO3、 NaOH、 BaCl2和盐酸,则最后得到的氯化钠溶液中一定含有杂质________________。
(4)操作Ⅳ的方法可以是:先在滤液中滴入酚酞溶液,再逐滴滴入盐酸直到滤液的 pH=7 的依据的现象是溶液由____________,如果加入的盐酸有点过量了,对后面 NaCl 溶液的结晶是否有影响______(是或否)
【答案】AC ![]() 或
或![]() 或
或![]()
![]() 过滤 烧杯 BaCl2 红色变成无色 否
过滤 烧杯 BaCl2 红色变成无色 否
【解析】
实验一:方案A利用一氧化碳和氧化铜在加热条件下反应生成二氧化碳和铜,反应方程式为![]() ,可以除去二氧化碳中的一氧化碳,方案合理;方案B,由于二氧化碳不燃烧也不支持燃烧,在有大量二氧化碳存在的情况下,无法实现一氧化碳的点燃,方案不合理;方案C利用氢氧化钠与二氧化碳反应生成碳酸钠和水,一氧化碳与氢氧化钠不反应实现除去一氧化碳,再利用碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,又生成了二氧化碳,反应的化学方程式分别为
,可以除去二氧化碳中的一氧化碳,方案合理;方案B,由于二氧化碳不燃烧也不支持燃烧,在有大量二氧化碳存在的情况下,无法实现一氧化碳的点燃,方案不合理;方案C利用氢氧化钠与二氧化碳反应生成碳酸钠和水,一氧化碳与氢氧化钠不反应实现除去一氧化碳,再利用碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,又生成了二氧化碳,反应的化学方程式分别为![]() 、
、![]() ,最终实现除去一氧化碳的目的,方案合理;综上所述方案中合理的AC。
,最终实现除去一氧化碳的目的,方案合理;综上所述方案中合理的AC。
实验二:由流程图可知,加入氢氧化钠可以除去氯化镁,因为氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,加入氯化钡除去硫酸钠,硫化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入碳酸钠除去氯化钙,氯化钙与碳酸钠反应生成碳酸钙沉淀和氯化钠,为了保证杂质完全除去,加入试剂要过量,过量的氯化钡的同时引入了新的杂质,加入碳酸钠还可以除去氯化钡,氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,通过过滤除去相应的沉淀,再加入稀盐酸除去过量的氢氧化钠和碳酸钠,氢氧化钠与稀盐酸反应生成氯化钠和水,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,则有:
(1)加入稍过量的 Na2CO3溶液除了能除去粗盐中的 CaCl2外,它还有一个作用是除去过量的氯化钡,氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,反应的化学方程式为![]() 。
。
(2)实验操作Ⅲ实现固体和溶液的分离,该操作是过滤,要用到的玻璃仪器是玻璃棒、漏斗和烧杯。
(3)如果稍过量的试剂加入的顺序依次为:Na2CO3、NaOH、BaCl2和盐酸,氯化钡无法除去,则最后得到的氯化钠溶液中一定含有杂质氯化钡。
(4)氢氧化钠与稀盐酸反应生成氯化钠和水,溶液由碱性变为中性,若盐酸过量,溶液变为酸性,操作Ⅳ的方法可以是:先在滤液中滴入酚酞溶液,溶液呈红色,再逐滴滴入盐酸直到滤液的 pH=7,现象是溶液由红色变为无色,如果加入的盐酸有点过量了,对后面 NaCl溶液的结晶没有影响,因为氯化氢在蒸发结晶的过程中会受热挥发,故填否。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】下表中,有关量的变化图像与其对应叙述相符的是( )
A | B | C | D |
|
|
|
|
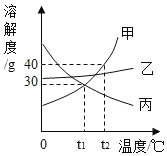
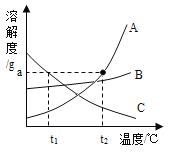
该图像可描述将一定量的水通直流电生成氢气质量随时间变化的情况 | t2℃时,相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量大于B的饱和溶液中所含水的质量 | 该图像可以描述石灰水 变质过程中溶液质量随时间变化的情况 | 向盛有HC1和CuCl2混合溶液的烧杯中逐滴加入NaOH溶液至过量 |
A.AB.BC.CD.D