题目内容
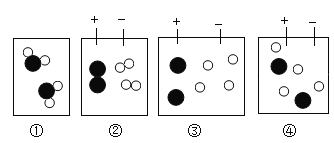
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
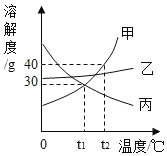
A.甲和丙的溶解度相等
B.降温可使丙物质的不饱和溶液变成饱和溶液
C.t1℃时,甲、乙和丙各 30g 分别加入 100g 水中,均形成饱和溶液
D.t2℃时,将 30g 甲物质加入 100g 水中,再降温到 t1℃时,所得溶液溶质的质量分数不变
【答案】D
【解析】
A、如图所示,t1℃时,甲和丙的溶解度曲线出现了交点,说明该温度时二者的溶解度相等,A选项说法不正确,不符合题意;
B、由丙的溶解度曲线可知丙的溶解度随着温度的升高而减小,升温可使丙物质的不饱和溶液变成饱和溶液,B选项说法不正确,不符合题意;
C、t1℃时,甲和丙的溶解度为30g,乙的溶解度大于30g,该温度下,甲、乙和丙各30g分别加入100g水中,甲和丙形成饱和溶液,乙形成的是不饱和溶液,C选项说法不正确,不符合题意;
D、甲的溶解度随着温度的升高而增大,t1℃时,甲的溶解度为30g,t2℃时,甲的溶解度为40g,t2℃时,将30g甲物质加入100g水中,得到不饱和溶液,降温到t1℃时,恰好为饱和溶液,没有溶质析出,所得溶液溶质的质量分数不变,D选项说法正确,符合题意。故选D。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案【题目】物质除杂是化学实验中经常遇到的问题。
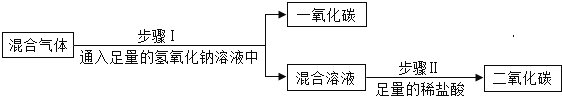
实验一:为除去二氧化碳气体中混有的少量一氧化碳,小明设计了三种方案。
实验方案 | |
方案 A |
|
方案 B |
|
方案 C |
|
上述方案中有两个方案是合理的,他们是___________写出合理方案中任意一个反应的化学方程式 ____________。
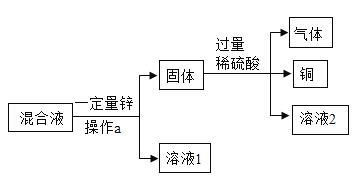
实验二:由于粗盐中含有少量 MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图:
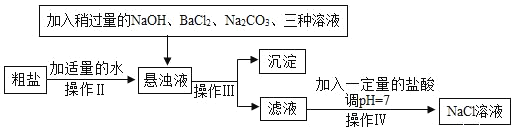
(1)加入稍过量的 Na2CO3溶液除了能除去粗盐中的 CaCl2外,它还有一个作用是 _____________(用化学方程式表示)
(2)实验操作Ⅲ是_____________,要用到的实验玻璃仪器是玻璃棒、漏斗和 ________________。
(3)如果稍过量的试剂加入的顺序依次为:Na2CO3、 NaOH、 BaCl2和盐酸,则最后得到的氯化钠溶液中一定含有杂质________________。
(4)操作Ⅳ的方法可以是:先在滤液中滴入酚酞溶液,再逐滴滴入盐酸直到滤液的 pH=7 的依据的现象是溶液由____________,如果加入的盐酸有点过量了,对后面 NaCl 溶液的结晶是否有影响______(是或否)
【题目】利用表中装置进行下列实验。已知:白磷的着火点为40℃。
实验装置 | 实验步骤 |
| Ⅰ.集气瓶的容积为250mL,实验开始前在集气瓶内加入50mL蒸馏水;在燃烧匙内加入足量白磷,塞紧瓶塞;取下注射器,吸入足量的、红颜色的水,再连接好装置。 Ⅱ.将组装好的实验装置转移到80℃热水中浸泡,片刻后白磷燃烧。 Ⅲ.待白磷熄灭后,再将整套装置放入冷水中冷却至室温。 |
(1)组装仪器后,用手向上拉动注射器活塞。松开手后,观察到________________,说明此装置气密性良好。
(2)冷却后进入集气瓶的红颜色的水的体积是_____mL。
(3)若在以上实验过程中,同时完成“验证可燃物燃烧需要满足温度达到着火点的条件”,还需补充的实验操作及现象是_______________________。