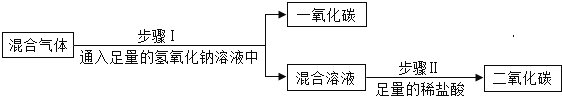
题目内容
【题目】实验室利用如图所示装置进行相关实验,根据要求回答问题。
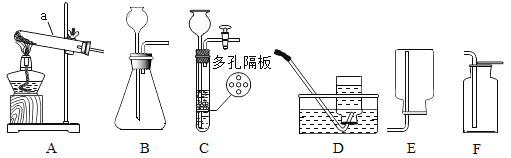
①写出仪器名称:a_________用氯酸钾和二氧化锰制氧气的发生装置是____(填字母序号),化学方程式为________,不能用E装置收集氧气的原因___________。
②发生装置可选装置C的是___________。
I.石灰石和稀盐酸制二氧化碳II.双氧水和二氧化锰制氧气III.锌块和稀硫酸制氢气
③石灰石与稀盐酸制二氧化碳的化学方程式为_________。
为测定产生二氧化碳的质量(假设二氧化碳已完全放出,忽略空气中物质的影响),设计如图装置:
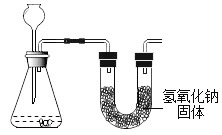
产生二氧化碳的质量____(填“大于”、“小于”或“等于”)氢氧化钠固体增加的质量。
④对锥形瓶中反应后的剩余溶液成分进行探究(杂质不溶于水且不参加反应),剩余溶液中一定有的溶质是____。把剩余溶液分成两份,分别置于两个试管中进行实验。
实验I.往一个试管中滴加硝酸银溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解。
实验II.往另一个试管中逐滴滴入碳酸钠溶液,并用pH传感器连续监测试管内溶液的pH,得下图
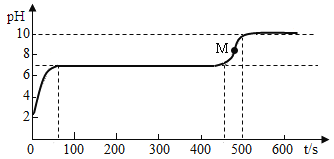
根据实验_____(填编号)可知,剩余溶液中还有盐酸。
⑤曲线上M点溶液的溶质成分是___________。
【答案】试管 A 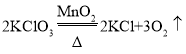 氧气的密度比空气大 I、 III
氧气的密度比空气大 I、 III ![]() 小于 CaCl2 II NaCl、Na2CO3
小于 CaCl2 II NaCl、Na2CO3
【解析】
①仪器名称:a试管,用氯酸钾和二氧化锰制氧气的发生装置是固-固加热型发生装置A,化学方程式为: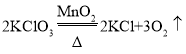 ,不能用E装置收集氧气的原因氧气的密度比空气大;
,不能用E装置收集氧气的原因氧气的密度比空气大;
②发生装置C是固-液常温型,且能控制反应的发生和停止,一般块状固体和液体常温下反应制取气体时使用,I、III符合,II中固体是粉末,不符合,故选I、III;
③石灰石与稀盐酸制二氧化碳的化学方程式为![]() ;
;
为测定产生二氧化碳的质量(假设二氧化碳已完全放出,忽略空气中物质的影响),设计如图装置:由于氢氧化钠后没有干燥装置,导致氢氧化钠会吸收空气中的二氧化碳和水蒸气,产生二氧化碳的质量小于氢氧化钠固体增加的质量;
④对锥形瓶中反应后的剩余溶液成分进行探究(杂质不溶于水且不参加反应),剩余溶液中一定有的溶质是氯化钙。把剩余溶液分成两份,分别置于两个试管中进行实验。
实验I.往一个试管中滴加硝酸银溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,说明溶液中有氯离子;
实验II.往另一个试管中逐滴滴入碳酸钠溶液,并用pH传感器连续监测试管内溶液的pH,实验中pH变化如图,根据实验II可知,溶液开始呈酸性,说明剩余溶液中还有盐酸;
⑤氯化钙和盐酸的混合溶液中加入碳酸钠,碳酸钠先和盐酸反应生成氯化钠、二氧化碳、水,后与氯化钙反应生成碳酸钙沉淀和氯化钠,曲线上M点碳酸钠溶液过量,溶液的溶质成分是NaCl、Na2CO3。

【题目】物质除杂是化学实验中经常遇到的问题。
实验一:为除去二氧化碳气体中混有的少量一氧化碳,小明设计了三种方案。
实验方案 | |
方案 A |
|
方案 B |
|
方案 C |
|
上述方案中有两个方案是合理的,他们是___________写出合理方案中任意一个反应的化学方程式 ____________。
实验二:由于粗盐中含有少量 MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图:
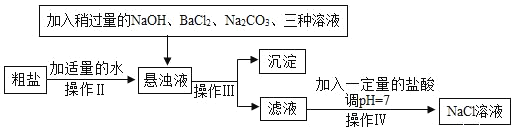
(1)加入稍过量的 Na2CO3溶液除了能除去粗盐中的 CaCl2外,它还有一个作用是 _____________(用化学方程式表示)
(2)实验操作Ⅲ是_____________,要用到的实验玻璃仪器是玻璃棒、漏斗和 ________________。
(3)如果稍过量的试剂加入的顺序依次为:Na2CO3、 NaOH、 BaCl2和盐酸,则最后得到的氯化钠溶液中一定含有杂质________________。
(4)操作Ⅳ的方法可以是:先在滤液中滴入酚酞溶液,再逐滴滴入盐酸直到滤液的 pH=7 的依据的现象是溶液由____________,如果加入的盐酸有点过量了,对后面 NaCl 溶液的结晶是否有影响______(是或否)
【题目】某兴趣小组的同学在实验室看到了一瓶久置的过氧化钠,发现它已变为白色粉末,同学们决定对该白色粉末的成分进行探究:
[提出问题]白色粉末含有哪些成分?
[查阅资料]①过氧化钠(Na2O2)为淡黄色粉末;②过氧化钠与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气;③碳酸钡、碳酸钙不溶于水。
[猜想与假设]
猜想一:白色粉末含有Na2O2和NaOH;
猜想二:白色粉末只有NaOH;
猜想三:白色粉末只有Na2CO3 ;
猜想四:白色粉末含有_________________。
[交流与讨论]
同学们认为猜想一不正确,原因是_________________;但小何同学认为仅靠视觉判断物质的组成不可靠,要通过实验来确认有无Na2O2。
[实验探究]小组同学设计了如下实验方案,请完成相关内容:
步骤 | 实验操作 | 实验现象 | 结论 |
① | 取少量样品于试管中,滴加适量的水 | ________ | 白色粉末不含有Na2O2 |
② | 取少量样品于试管中溶解,滴入足量的CaCl2溶液 | ________ | 白色粉末含有Na2CO3 |
③ | 取步骤②中反应后的上层清液,滴入________ | 溶液变红 | 白色粉末含有NaOH |
[实验结论]由上述实验可知猜想四成立,该粉末已全部变质。
[反思拓展]写出步骤②中发生反应的化学方程式:_________________。