题目内容
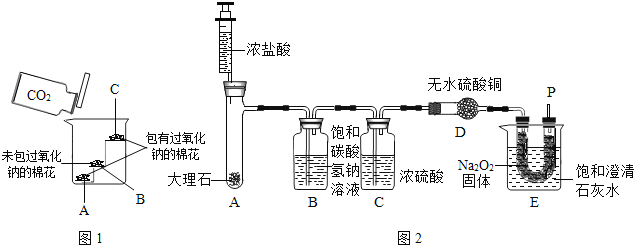
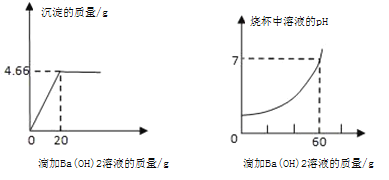
【题目】实验小组用pH传感器探究稀盐酸和氢氧化钠溶液的反应。实验操作和测定结果如图所示:

(1)盐酸和氢氧化钠反应的化学方程式为_____。
(2)该实验中,甲溶液是_____。
(3)能说明盐酸与氢氧化钠发生化学反应的依据是_____。
【答案】HCl+NaOH═NaCl+H2O 氢氧化钠溶液 pH由小于7变到大于(或等于)7
【解析】
(1)盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH═NaCl+H2O。
(2)图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中,故甲溶液为氢氧化钠。
(3)稀盐酸显酸性,过程中pH传感器显示pH由小于7变到大于7,说明稀盐酸与氢氧化钠发生了反应。

练习册系列答案
相关题目
【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
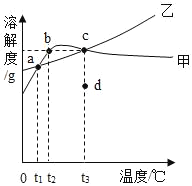
A. t3应介于40℃~50℃
B. 将t3℃时Na2SO4的饱和溶液降温至t1℃,c点将沿曲线c→b→a运动
C. 甲、乙饱和溶液从t2升温到t3,溶质的质量分数都不变
D. 将d点甲、乙溶液移至c点,可采用的方法只有加入溶质甲、乙,且溶质质量分数增大