��Ŀ����
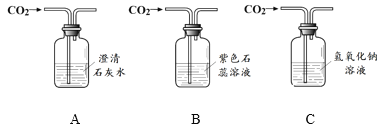
����Ŀ���������ƣ�Na2O2����һ�ֵ���ɫ���壮��һ�οƼ���У���ѧ��ȤС���������ͼ1��ʾ��ʵ�飬����A��C�ǰ��й������Ƶ�����B��δ���������Ƶ�����ʵ���й۲쵽A��C������ȼ�գ�B��δȼ�գ�
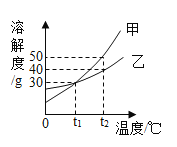
��1��B�����������_____��
��2������ȼ�գ������������ǿ�ȼ��֮�⣬��������_____��������
��������⣩����ʵ��������θ����ṩȼ�������ģ�
���������ϣ�
1��Na2O2��ϡ���ᷴӦʱ������NaCl��H2O��O2��
2���ڳ�����Na2O2��CO2��H2O���ܷ�����ѧ��Ӧ��
3����ˮ����ͭΪ��ɫ���壬��ˮ���Ϊ��ɫ��
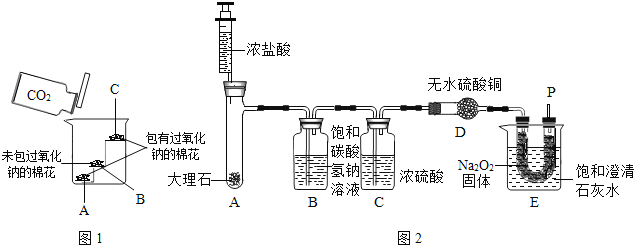
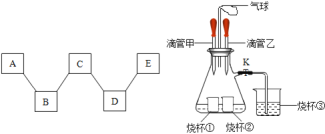
��ʵ����ƣ��������ۣ�С��ͬѧ�������ͼ2��ʾװ�ý���ʵ��̽����
��ʵ�鲽�裩
���������װ�õ������ԣ�
������ص��Լ������Ӧ�������ڣ�
�������ƶ���Ͳ�Ļ�������ϡ����ע���Թ��ڣ�
��һ��ʱ�����P������һ�������ǵ�ľ�����۲�����
��ʵ������
����ˮ����ͭû�б���ɫ��
��_____��
��_____��
��ʵ�������
��3��Bװ�õ�������_____��
��4��Eװ���в��������ԭ����_____��
��ʵ����ۣ�
��Na2O2��CO2��Ӧ������һ�����壬ʹͼ1�е���������ȼ�յ�һ��������
��Na2O2��CO2��Ӧ�����а��������仯��ʹͼ1�е���������ȼ�յ���һ��������
����չ��ߣ�
��Na2O2��CO2��Ӧ������һ�������⣬��������һ�ֹ��壬ѧ������Ϊ���ɵĹ�����NaOH��ѧ������Ϊ��Na2CO3��ͬѧ�Ǿ�˼������Ϊ_____ͬѧ�IJ����Ǵ���ģ�������_____��
��д��Na2O2��CO2��Ӧ�Ļ�ѧ����ʽ_____��
���𰸡���1������ʵ�顣
��2���������Ӵ����¶ȴﵽ�����Ż�����ϡ�
��ʵ��������E��ʯ��ˮ����ǣ�
��P��������ľ����ȼ��
��ʵ�������
��3����ȥA��Ũ����ӷ������Ȼ������塣
��4��Na2O2��CO2��Ӧ�ų�������ʹ�ձ�E��ʯ��ˮ�¶����ߣ�����Ca(OH)2�ܽ�����¶����߶���С��������µ��±���ʯ��ˮ��������Ca(OH)2���������ǡ�
����չ��ߡ����ף���Ӧǰû��HԪ�أ���˲���������NaOH��
��2 Na2O2��2CO2 2Na2CO3��O2��
��������
��1��A��C�ǰ��й������Ƶ�����B��δ���������Ƶ�����ʵ���й۲쵽A��C������ȼ�գ�B��δȼ�գ��ǽ�B��A��C�Աȣ��Ӷ��ó����ۣ�
��2������ȼ����Ҫ�����������������ǿ�ȼ�����������Ӵ����¶ȴﵽ�Ż�㣮���ǿ�ȼ���ȱ����������������
��ʵ��������ʯ��Ũ���ᷴӦ���ɶ�����̼������Bװ�ã����͵�̼��������Һ����Ũ����ӷ��������Ȼ������巴Ӧ�Ӷ���ȥ�Ȼ������壻ͨ��C�õ�����Ķ�����̼����ȥ���е�ˮ��������D��������E�й������ƹ����������̼��Ӧ���ȣ��������Ƶ��ܽ�������¶����߶���С���������������ʯ��ˮ����ǣ����������������̼��Ӧ����������ʹP�������ǵ�ľ����ȼ��
��ʵ�������
��3��Eװ������Ҫ�����Ķ�����̼��������̼��̼��������Һ����Ӧ���Ȼ���������֮�ɷ�Ӧ�Ӷ�����ȥ��
��4��Na2O2��CO2��Ӧ�ų�������ʹ�ձ�E��ʯ��ˮ�¶����ߣ�����Ca��OH��2�ܽ�����¶����߶���С��������µ��±���ʯ��ˮ��������Ca��OH��2���������ǣ�
����չ��ߡ������������غ㶨�ɣ���ѧ��Ӧǰ��Ԫ�ص�����䣻����Ӧǰ��������Na2O2��CO2��û��HԪ�أ���˲���������NaOH���ʼ�ͬѧ�������
��Na2O2��CO2��Ӧ����̼���ƺ�����������ʽ�ǣ�2Na2O2+2CO2�T2Na2CO3+O2����

����Ŀ�����¾�Ϊ���л�ѧ�������ʣ���H��C��N��O��S��Na��Ca��Fe��Ԫ���е�һ�ֻ�����ɣ���ѧС��������ͼʵ�飬��ش�
��1������ͬѧʵ���й۲쵽��Һ����ɫ��Ϊdz��ɫ��������Ӧ�ķ���ʽΪ_____��
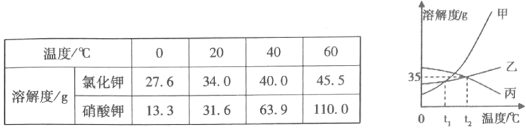
��2������ͬѧͨ��ʵ�鷢����������֮��Ĺ�ϵ��ͼ��ʾ�������������˵�������һ�������¿��Է�Ӧ����A��E�ֱ����ڵ��ʡ�������ᡢ����е�����������к�ɫ���塢��ɫ���塢��ɫ��Һ���������ݵ������������C�Ļ�ѧʽΪ_____��D��E��Ӧ�Ļ�ѧ����ʽΪ_____��A��B��Ӧ�Ļ�ѧ����ʽΪ_____��
��3������ͬѧ��ͼ2����ʵ�飬�ȹرյ��ɼ�K�������е�Һ�強�����۲쵽�������Թ���һ��ʱ���ָ�ԭ״���ٽ����е�Һ�強�������ɼ�K���ձ�����Һ�嵹������ƿ�У�����ƿ�ײ���Һ�ɺ�ɫ��Ϊ��ɫ�����������������뽫�±��е��Լ�����������
�ιܼ� | �ձ��� | �ι��� | �ձ��� | ��ƿ����Һ | �ձ��� | |
�Լ� | H2O | _____ | _____ | _____ | _____ | _____ |
����Ŀ��ij��ѧ��ȤС���������ұ�������ʷdz�����Ȥ��ͬѧ�dz�ȡ��20g������Ʒ����������Ϊ10.0g���ձ��У���20gϡ�����4�μ����ձ��С��ڻ�ѧ��Ӧ�����ж��ձ�(������Һ����)��������γ�������¼���±���
��������/g | 5 | 5 | 5 | 5 |
��Ӧ���ձ���ҩƷ����/g | 34.8 | 39.6 | 44.4 | 49.3 |
(1)��Ʒ��ȫ��Ӧ����H2��������____�ˣ�������Ʒ�����ĺ�����___?(��ȷ��0.1��)
(2)���������л�����Ӧ������ͼ_____(������Ϊ����������������趨�������ʣ�����������б�Ҫ������)��

(3)��������������ᷴӦ�����ٶ��ɿ������ԭ����____��
(4)����������һ����̼��ԭ����ʯ�õ���ͬѧ����ʵ������CO��Fe2O3����������ǿ��ģ����������(�ܱ�������)��һ��ʱ����ռ����������ݣ�
���� | CO | Fe2O3 | Fe | M | CO2 |
��Ӧǰ����(g) | 2.8 | 16 | 0 | 0 | 0 |
��Ӧ������(g) | 0 | 0 | 0 | a | b |
CO