题目内容
【题目】某混合溶液中含有硫酸和盐酸,取该混合溶液20g于烧杯中,不断滴加氢氧化钡溶液,反应过程中烧杯中产生沉淀的质量、溶液pH的变化如图所示(BaCl2溶液呈中性)。求:
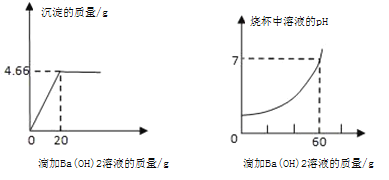
(1)完全反应后生成沉淀的质量为_____g;
(2)氢氧化钡溶液的质量分数为_____;
(3)计算20g混合溶液中HCl的质量为多少?_____
【答案】4.66 17.1% 2.92g
【解析】
根据图可知,生成4.66g 沉淀消耗的氢氧化钡溶液的质量为20g,而总消耗的氢氧化钡的溶液的质量为60g,则与盐酸反应的氢氧化钡溶液的质量为60g﹣20g=40g,据此结合对应的化学方程式求算。
由图可知生成沉淀的质量为4.66g,与硫酸反应的氢氧化钡溶液的质量为20g
设氢氧化钡溶液的质量分数为x
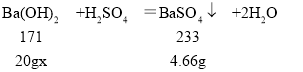
![]()
x=17.1%
与盐酸反应的氢氧化钡溶液的质量为60g﹣20g=40g
设20g混合溶液中HCl的质量为y
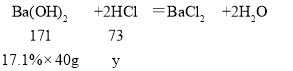
![]()
y=2.92g
故填:(1)4.66;(2)17.1%;(3)2.92g

练习册系列答案
相关题目