题目内容
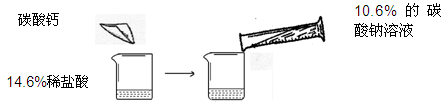
某钢铁厂需要测定一批生锈较严重的废钢材的锈蚀程度(假定该废钢成分为铁、氧化铁和杂质,杂质不溶于水不发生任何反应,而硫酸先与氧化铁反应),取该样品28g加入一洁净的烧杯中,再将足量的250克稀硫酸平均分为5次加入到烧杯中,获得实验数据如下:
将烧杯内物质过滤得到滤液276.8g,试回答下列问题:(注:该题用初中知识解答)
(1)上述过程中生成气体的化学方程式为: ;
(2)共生成气体的质量是 ;
(3)根据已知条件列出求解参加反应的单质铁的质量(x)的比例式 ;
(4)所用稀硫酸的溶质质量分数是 ;
(5)该样品中被锈蚀的铁元素占原钢材(被锈蚀前的)的质量分数为 。(取整数)
| 稀硫酸质量(单位/g) | 50 | 50 | 50 | 50 | 50 |
| 烧杯内剩余物质总质量(单位/g) | 78 | 128 | 178 | 227.8 | 277.6 |
将烧杯内物质过滤得到滤液276.8g,试回答下列问题:(注:该题用初中知识解答)
(1)上述过程中生成气体的化学方程式为: ;
(2)共生成气体的质量是 ;
(3)根据已知条件列出求解参加反应的单质铁的质量(x)的比例式 ;
(4)所用稀硫酸的溶质质量分数是 ;
(5)该样品中被锈蚀的铁元素占原钢材(被锈蚀前的)的质量分数为 。(取整数)
(1)Fe+H2SO4=FeSO4+H2 ↑
(2)0.4g
(3)56/2=X/0.4g
(4)19.6%
(5)48%
(2)0.4g
(3)56/2=X/0.4g
(4)19.6%
(5)48%
试题分析:(1)铁与硫酸反应生成硫酸亚铁和氢气;
(2)根据表格,加入的物质的总质量为278g,反应后烧杯内剩余物质总质量277.6g,依据质量守恒定律,减少的质量为生成的氢气的质量:278g-277.6g=0.4g ;
(3)依据质量守恒定律,利用化学方程式根据氢气的质量可求出铁的质量
设铁的质量为X,则:
Fe+H2SO4=FeSO4+H2 ↑
56 2
X 0.4g
56/2=X/0.4g
X=11.2g
(4)设参加50g硫酸溶液中溶质的质量为y:
Fe+H2SO4=FeSO4+H2 ↑
98 2
Y 0.2g
98/2=y/0.2g
X=9.8g
稀硫酸的溶质质量分数=9.8g/50g ×100%=19.6%
(5)根据数据,与氧化铁反应的硫酸的质量无谓150g,溶质的质量=150g×19.6%=29.4g,利用化学方程式可求出氧化铁的质量,根据氧化铁的质量可求出氧化铁中铁元素的质量。
Fe2O3+H2SO4=Fe2 (SO4) 3+H2O
160 98
Z 29.4g
160/98=z/29.4g
Z=29.4g
铁元素的质量=29.4g×112/160 =20.58g
铁的质量=20.58g+11.2g=31.68g
被锈蚀的铁元素占原钢材(被锈蚀前的)的质量分数=20.58g/31.68g×100%=48%

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2Fe+3CO2。
2Fe+3CO2。