题目内容
我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为: 3CO+Fe2O3 2Fe+3CO2。
2Fe+3CO2。
(1)求Fe2O3中铁元素的质量分数。
(2)根据化学方程式计算:用含Fe2O360%的赤铁矿石800 t,理论上可炼出纯铁多少吨?
 2Fe+3CO2。
2Fe+3CO2。(1)求Fe2O3中铁元素的质量分数。
(2)根据化学方程式计算:用含Fe2O360%的赤铁矿石800 t,理论上可炼出纯铁多少吨?
(1) 70% (2)336t
(1)Fe2O3中铁元素的相对原子质量之和与Fe2O3的相对分子质量之比就是Fe2O3中铁的质量分数。即 ×100%=
×100%=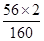 ×100%=70%
×100%=70%
(2)800 t矿石中Fe2O3的质量=800 t60%=480 t,根据化学方程式可求出生成纯铁的质量。
(2)解:设理论上可炼出纯铁的质量为x。
Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
160 112
800 t60% x
 =
= x=336 t
x=336 t
答:理论上可炼出纯铁336 t。
 ×100%=
×100%=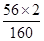 ×100%=70%
×100%=70%(2)800 t矿石中Fe2O3的质量=800 t60%=480 t,根据化学方程式可求出生成纯铁的质量。
(2)解:设理论上可炼出纯铁的质量为x。
Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2160 112
800 t60% x
 =
= x=336 t
x=336 t答:理论上可炼出纯铁336 t。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
