题目内容
将KCl和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的0.44g.
(1)原混合物中Ca(OH)2的质量为______g;
(2)写出溶液中生成沉淀的质量m(g)与通入CO2的质量M(g)之间的函数表达式
①______;②______;
(3)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的质量M(g)的关系曲线.
(1)原混合物中Ca(OH)2的质量为______g;
(2)写出溶液中生成沉淀的质量m(g)与通入CO2的质量M(g)之间的函数表达式
①______;②______;
(3)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的质量M(g)的关系曲线.

(1)设与0.44g二氧化碳反应消耗氢氧化钙的质量为X,生成沉淀质量为Y则:
CO2+Ca(OH)2═CaCO3↓+H2O
44 74 100
0.44g X Y
根据:
=
解得X=0.74g;根据
=
解得Y=1g.
(2)CO2+Ca(OH)2═CaCO3↓+H2O
44 100
M m
根据:
=
解得m=
,M的取值为0≤M<0.44;
CaCO3+H2O+CO2═Ca(HCO3)2
100 44
m M
根据:
=
解得m=
,但是这是二氧化碳多于0.44g后消耗的碳酸钙的质量关系,所以还剩碳酸钙的质量等于生成碳酸钙最大值1减去消耗的碳酸钙的质量即:m=1-
或
或2-(100M/44)
M取值范围:0.44≤M≤0.88
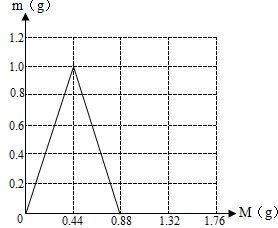
(3)生成碳酸钙最大值是1,再通入二氧化碳碳酸钙就会减少,当通到0.88g二氧化碳碳酸钙正好被消耗完.把0点、1g、0.88三个点连接起来即可.
故答案为:(1)0.74
(2)①0≤M<0.44 m=100M/44
②0.44≤M≤0.88 m=1-
或
或2-(100M/44)或其它合理答案
(4)(作图必须完全正确方可得分,见图)
CO2+Ca(OH)2═CaCO3↓+H2O
44 74 100
0.44g X Y
根据:
| 44 |
| 74 |
| 0.44g |
| X |
| 44 |
| 100 |
| 0.44g |
| Y |
(2)CO2+Ca(OH)2═CaCO3↓+H2O
44 100
M m
根据:
| 44 |
| 100 |
| M |
| m |
| 100M |
| 44 |
CaCO3+H2O+CO2═Ca(HCO3)2
100 44
m M
根据:
| 100 |
| 44 |
| m |
| M |
| 100M |
| 44 |
| 100(M-0.44) |
| 44 |
| 88-100M |
| 44 |
M取值范围:0.44≤M≤0.88
(3)生成碳酸钙最大值是1,再通入二氧化碳碳酸钙就会减少,当通到0.88g二氧化碳碳酸钙正好被消耗完.把0点、1g、0.88三个点连接起来即可.
故答案为:(1)0.74
(2)①0≤M<0.44 m=100M/44
②0.44≤M≤0.88 m=1-
| 100(M-0.44) |
| 44 |
| 88-100M |
| 44 |
(4)(作图必须完全正确方可得分,见图)


练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目

