题目内容
【题目】今天是实验室的开放日,某小组的同学利用下列装置进行实验.
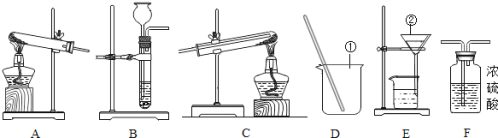
(1)写出图中指定仪器的名称:①_____;②_____.
(2)实验室制取H2,应选取的装置为_____(填装置编号),反应原理为_____(用化学方程式表示),若要使制取的H2干燥,则需要将氢气通入_____(填装置编号)中.
(3)若制取氢气时需要100g9.8%的稀硫酸,配制上述稀硫酸需要98%的浓硫酸(密度为1.84g/cm3).配制过程中,除上图装置中的仪器外,还缺少的仪器有_____(填序号).
①天平 ②胶头滴管 ③药匙 ④10mL量筒 ⑤100mL量筒
(4)还原氧化铜的实验结束后,同学们发现得到的铜中还混有未反应的氧化铜.为了得到纯净的铜,他们进行了以下实验操作:
操作 | 简答 |
反应后的固体放入烧杯中,加入足量的稀硫酸,搅拌,使其充分反应. | 加足量稀硫酸的目的是:_____ |
②将操作①中所得的混合物过滤. | 滤液中所含有的溶质是:_____ |
③将操作②所得的滤渣洗涤、烘干,得到纯净的铜. | —— |
【答案】烧杯 漏斗 B Zn+H2SO4=ZnSO4+H2↑ F ②④⑤ 使氧化铜充分反应完 CuSO4、H2SO4
【解析】
解:(1)据图可知仪器①是烧杯;②是漏斗;
(2)实验室制取氢气常用锌和稀硫酸反应,采用固液反应装置,应选择装置B,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;干燥氢气常用浓硫酸,因其具吸水性,应选择装置F;
(3)稀释浓硫酸时,根据稀释前后容质量不变计算所需浓硫酸的质量,再由密度求其体积量,即:100g×9.8%═浓硫酸质量×98%,浓硫酸质量═10g,需要水的质量=100g-10g=90g;由密度公式求得浓硫酸体积═5.4mL,稀释浓硫酸用到烧杯、玻璃棒、胶头滴管、10mL量筒、100mL量筒,故填:②④⑤;
(4)反应后的固体放入烧杯中,加入足量的稀硫酸,铜不反应,氧化铜和硫酸反应生成硫酸铜溶液和水,所以加足量稀硫酸的目的是:使氧化铜充分反应完;由于加入足量的稀硫酸,过滤后的滤液中含有CuSO4、H2SO4。

【题目】(1)英国科学家法拉第曾以蜡烛为主题,对青少年发表了一系列演讲,其演讲内容被编成《蜡烛的化学史》一书。下列有关蜡烛燃烧的叙述正确的是(________)
A 蜡烛燃烧时,在顶端会形成一个液态石蜡的凹槽
B 用玻璃管从蜡烛火焰中引出的白烟是水蒸气
C 蜡烛燃烧时,液态石蜡抵达烛芯上汽化并燃烧
(2)“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
[提出问题]氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
[实验探究]
实验步骤 | 实验现象 |
I.分别量取5 ml 5%过氧化氢溶液放入A、B两支试管中,向A试管中加入a g氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,试管中均产生气泡,带火星木条均复燃如此反复多次试验,观察现象。 | 式管中均产生气泡,带火星木条均复燃 |
III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为a g。 | / |
IV.分别量取5 ml 5%过氧化氢溶液放入C、D两支试管中,向C试管中加入a g氧化铁粉末,向D试管中加入a g二氧化锰粉末,观察现象。 | / |
[实验结论]
①A中产生的气体是_____。
②实验II、III证明:氧化铁的_____和_____在反应前后均没有发生变化,可以作过氧化氢分解的催化剂。
[实验评价]
③实验设计IV的目的是_____。
(3)10 g A和足量B混合加热,充分反应后10 g A生成6 g C和8 g D,则参加反应的A和B的质量比为(________)
A 1∶1 B 2∶3 C 4∶1 D 5∶2
【题目】以下是姚池小朋友血液中某些元素检测结果的报告单(部分):根据此份报告单并结合自己所学知识回答以下问题:(姓名:姚池 性别:女 年龄:5岁;标本种类:血样本号:YS0130报告日期:2009-9-10)
序号 | 检测项目 | 结果 | 参考值 |
1 | 锌 | 7.7 | 11~22 μmol·L-1 |
2 | 铜 | 16.9 | 14~29 μmol·L-1 |
3 | 铁 | 17.8 | 9.0~21.5μmol·L-1 |
4 | 钙 | 2.0 | 2.2~2.7μmol·L-1 |
5 | 镁 | 0.84 | 0.8~1.2μmol·L-1 |
6 | 铅 | 0.28 | 0~0.48μmol·L-1 |
(1)姚池缺乏的常量元素是______(填元素符号);姚池缺乏此元素会_______;检测项目中属于有害元素的是_____(填元素名称)。
(2)根据检测结果,医生建议她每天补充10 mg的锌,姚池的爸爸给她买了下面的补锌剂:
(药品名称)葡萄糖酸锌片
(形状)片剂,味酸甜,微涩,有薄荷味.
(药品组成)每片含葡萄糖酸锌(C12H22O14Zn)35毫克.试通过计算说明姚池每天一共应该吃____________片。
(3)姚池妈妈认为葡萄糖酸锌片是营养补剂,多吃几片没关系。请你评价这一观点,并说出理由________________。