题目内容
【题目】下图为甲、乙、丙三种固体物质在水中的溶解度曲线,下列说法正确的是
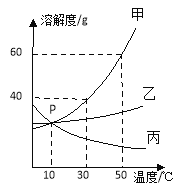
A. 50℃时,分别将等质量的甲和乙溶于适量的水恰好配成饱和溶液,所得溶液的质量前者比后者大
B. 若甲中混有少量的乙,最好采用蒸发结晶的方法提纯甲
C. 将50℃甲、乙、丙三种物质的饱和溶液降温到10℃,析出晶体最多的是甲
D. 向100g 50℃的水中加入65g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出,可能是因为甲物质溶于水显著放热
【答案】D
【解析】A、50℃时,甲的溶解度大于乙的溶解度,分别将等质量的甲和乙溶于适量的水恰好配成饱和溶液,所需要的水甲比乙少,所得溶液的质量前者比后者小,错误;B、甲的溶解度随温度升高变化明显,当甲溶液中混有少量的乙时,可采用降温结晶提纯甲,错误;C、50℃,甲、乙、丙三种物质的饱和溶液降温到10℃时,不知三种溶液质量大小,故无法判断析出晶体质量多少,错误;D、向100g50℃的水中加入65g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出,由于甲的溶解度随温度升高而增大,先溶解则说明温度升高了,后析出则说明温度降低了,甲溶于水会放出显著热量,正确。故选D。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
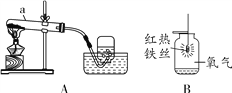
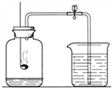
53天天练系列答案【题目】课外小组同学利用图A、图B所示装置验证碳酸钠的性质。

(1)利用图A装置进行如下实验
步骤一:向三口瓶内的碳酸钠溶液中滴加酚酞,溶液显红色。
步骤二:将注射器1的针头向瓶内推进,使针头下端进入瓶内液面下,向外拉注射器,此时注射器1中反应的化学方程式为 ,看到明显现象后,将针头向上拉至图示所示位置。
步骤三:验证碳酸钠是碳酸盐,应该进行的实验操作是 ,看到的实验现象是 。
(2)利用图B装置进行实验。将二氧化碳持续通入饱和碳酸钠溶液中,发生反应为:Na2CO3 + CO2 + H2O = 2NaHCO3↓,产生浑浊的原因是除反应消耗水使溶剂量减少外,还有的其它原因是 (请依据下表信息回答)。
物质 | 20℃时溶解度/g | 相对分子质量 |
Na2CO3 | 21.5 | 106 |
NaHCO3 | 9.6 | 84 |