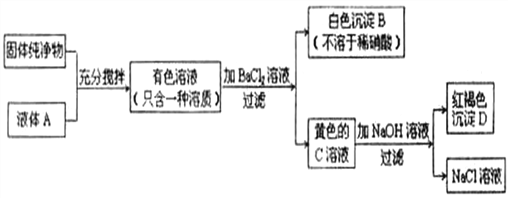
题目内容
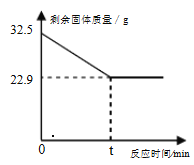
【题目】某氢氧化钠固体样品,可能含有固体氢氧化钾和不溶于酸的杂质A,取5.6g该样品与100g一定质量分数的稀盐酸反应,两者恰好完全反应,生成mg水。下列说法正确的是
A. 若样品不含任何杂质,则m < 1.8
B. 若m =1.8,则样品中一定含有杂质A,可能含有固体氢氧化钾
C. 若m =1.8,则样品中至少含有杂质A或固体氢氧化钾中的一种
D. 若样品中既含有A,也含有固体氢氧化钾,则一定m > 1.8
【答案】B
【解析】解:假设5.6g全部为氢氧化钠,则设生成水的质量为x,盐酸溶质的质量为y
NaOH+HCl═NaCl+H2O
40 36.5 18
5.6g y x
![]()
解得:x=2.52g y=5.11g
假设样品全部为氢氧化钾,则设生成水的质量为z
KOH+HCl═KCl+H2O
56 18
5.6g z
![]()
解得:z=1.8g
A、根据上述计算可以知道若样品不含任何杂质生成水的质量为2.52g,错误;B、因为全部为氢氧化钠生成水的质量为2.56g,所以若生成水的质量为1.8g,则说明在样品中一定含有杂质A,当然其中也可能含有氢氧化钾,正确;C、根据B的分析可以知道,若生成水的质量为1.8g,则说明在样品中一定含有杂质,但不可能只有含有氢氧化钾,因为,根据我们的计算可以知道,单独的氢氧化钠反应生成水的质量大于1.8g,而单独的氢氧化钾反应生成水的质量等于1.8g,所以如果样品中的杂质只含有氢氧化钾的话,生成的水的质量必然大于1.8g,错误;D、由题意可知,若样品中既含有A,也含有固体氢氧化钾,则m 可以小于或等于1.8,错误。故选B。

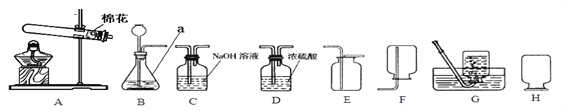
【题目】某实验小组模拟高炉炼铁的化学反应原理设计了用一氧化碳还原氧化铁的实验装置,如图所示:
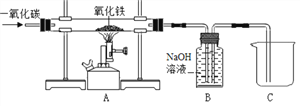
(提出问题)(1)实验所用的氧化铁完全反应后,玻璃管中剩余的黑色固体成分。
(2)反应后由B装置排到烧杯C中的溶液所含溶质的成分。
(查阅资料)
常见铁和铁的氧化物 | Fe | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 能 | 否 | 否 | 能 |
(探究1)玻璃管中剩余的黑色固体成分。
(初步验证)玻璃管中剩余固体为黑色,能全部被磁铁吸引。
实验小组的同学一致认为,黑色固体不可能是FeO和Fe2O3,理由是______。
(作出猜想)黑色固体可能:a.全部是Fe;b.全部是Fe3O4;c._______。
(设计实验)为确定黑色固体的成分,同学们设计了下列实验方案,请你一起参与探究活动。
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,加入_______ | ______ | 黑色固体全部是Fe3O4 |
(探究2)反应后由B装置排到烧杯C中的溶液所含溶质的成分。写出B装置中NaOH发生反应的化学方程式:_______
(作出猜想)猜想一:溶质是Na2CO3;猜想二:溶质是_______;
(设计实验)
实验操作 | 实验现象 | 实验结论 |
(1)取少量溶液于试管中,加入__________; | 产生白色沉淀 | 该反应的化学方程式为__________ |
(2)将(1)反应后的混合物过滤,取滤液加入________ | ___________ | 猜想一成立 |
(反思与交流)(1)B装置除了吸收CO2气体外,还有的作用是______;
(2)为了避免加热玻璃管时可能发生爆炸,在加热前应________。