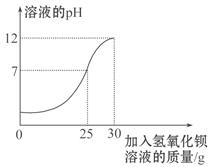
题目内容
为测定某MgSO4溶液的溶质质量分数,化学小组同学取MgSO4溶液100g,向其中加入一定溶质质量分数的NaOH溶液80g,二者恰好完全反应,生成沉淀5.8g.
请计算:
(1)该MgSO4溶液的溶质质量分数是多少?
(2)反应后所得溶液的质量是多少克?
(1)12% (2)174.2g
解析试题分析:(1)设参加反应的硫酸镁的质量是x
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
120 58
x 5.8g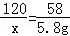
x=12g
故硫酸镁溶液的溶质质量分数为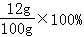 =12%
=12%
(2)反应后溶液的质量为100g+80g﹣5.8g=174.2g
答:(1)该MgSO4溶液的溶质质量分数是12%;(2)反应后所得溶液的质量是174.2g
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题考查根据化学方程式的相关计算,注意带入方程式计算的必须是实际参加反应的物质的量或实际生成的物质的量

练习册系列答案
相关题目
在化学反应A2+BC=B+A2C中,反应物BC与生成物 B的质量关系如图所示。将2g A2与80g BC恰好完全反应,则生成A2C的质量是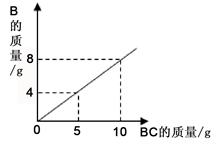
| A.64g |
| B.18g |
| C.80g |
| D.9g |