题目内容
四川泡菜深受人们喜爱.
(1)家庭用含NaCl 94%的袋装食用盐配制泡菜水,要求泡菜水中NaCl的质量分数为18.8%,则1000g水中需加袋装食用盐 g.
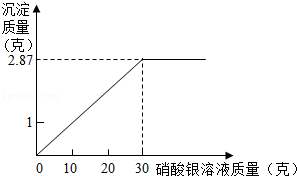
(2)要测定某泡菜水中NaCl的含量,取70mL澄清的泡菜水(密度为1.1g/cm3),加入足量的AgN03溶液,充分反应后滤出沉淀,洗净烘干后称得其质量为28.7g.假设泡菜水中的其他物质均不与AgN03溶液反应,求这种泡菜水中NaCl的质量分数.
(计算结果保留l位小数,无计算过程不给分)
(1)250;(2)泡菜水中NaCl的质量分数为15.2%.
解析试题分析:(1)设需要食用盐的质量m.则:18.8%= 解得:m=250g;
解得:m=250g;
(2)设所取泡菜水中NaCl的质量为x.
NaCl+AgN03═NaN03+AgCl↓
58.5 143.5
x 28.7g 解得:x=11.7g
解得:x=11.7g
泡菜水中NaCl的质量分数为: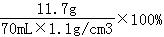 =15.2%
=15.2%
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本题主要考查了溶质质量分数和化学方程式的计算,属于基本的计算,难度不大,应加强计算,提高计算的能力.

 阅读快车系列答案
阅读快车系列答案我国早在春秋战国时期,就开始生产和使用铁器。某化学小组到钢铁厂做社会调查,将不同质量的生铁样品(假定其中只含铁和碳两种单质)分别放入5只烧杯中,各加入189.2 g质量分数相同的稀硫酸进行实验,实验数据见下表:
| | 烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ |
| 加入生铁样品 的质量/g | 3.0 | 6.0 | 9.0 | 12.4 | 14.0 |
| 充分反应后 生成气体 的质量/g | 0.1 | M | 0.3 | 0.4 | 0.4 |
试计算:
(1)表中M的值为________。
(2)烧杯④中完全反应后,所得溶液中溶质的质量是多少?(写出计算过程)
如图是某试剂瓶标签上的内容.
| 浓硫酸(分析纯) 化学式:H2SO4相对分子质量:98 密度:1.84g∕cm3质量分数;98% |
(1)把这种浓硫酸稀释为溶质质量分数是19.6%的硫酸溶液100g,需要这种硫酸的质量为
(2)将稀释后的硫酸溶液与200g氢氧化钠溶液恰好完全反应,求氢氧化钠溶液的溶质质量分数.
将50g20%的氯酸钾溶液稀释到200g,稀释后所得溶液中的溶质质量分数是( )
| A.1% | B.5% | C.10% | D.20% |
(6分)某含有杂质的CaCO3固体(杂质不溶于水,也不与酸反应),老师安排同学做测定该固体混合物中CaCO3质量分数的实验.利用电子天平测定的有关实验数据如下表:
| 称量项目 | 质量/g |
| 杂质和 CaCO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸(适量) | 141.20 |
| 锥形瓶+稀盐酸+杂质和CaCO3的混合物 (反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸+杂质和CaCO3的混合物 (反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸+杂质和CaCO3的混合物 (反应开始后55秒) | 149.00 |
(2)试通过分析计算固体混合物中CaCO3的质量分数?