题目内容
【题目】如图所示,在分别盛有100g水的烧杯中放入KNO3充分溶解,则说法正确的是( )
温度(℃) | t1 | t2 |
KNO3的溶解度(g/100g水) | 60 | 90 |
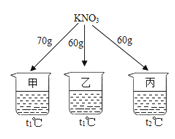
A. 乙、丙溶液中溶质质量相等
B. 乙升温至t2℃,溶液质量增加
C. 甲、乙混合后为t1℃的不饱和溶液
D. 丙降温至t1℃,有晶体析出
【答案】A
【解析】
溶解度是指在一定温度下,某固体物质100g溶剂里达到饱和时所溶解的质量。
A. 根据溶解度可知,乙、丙溶液中溶质质量相等,都是60g,选项正确;
B. 乙升温至t2℃时溶解度变大,但溶液中的溶质、溶剂的质量没有改变,所以溶液质量不变,选项错误;
C. 甲、乙均为t1℃时的饱和溶液,所以混合后为t1℃的饱和溶液,选项错误;
D. 丙和乙中溶质的质量都是60g,溶剂都是100g,t1℃时硝酸钾的溶解度为60g,故降温至t1℃,溶液刚好饱和,无晶体析出,选项错误。故选A。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
①为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
编号 | 实验药品 | 分解温度(℃) |
Ⅰ | 3.0gKClO3与1.0gMnO2均匀混合加热 | 350 |
Ⅱ | xgKClO3与1.0gCuO均匀混合加热 | 370 |
Ⅰ中反应的化学方程式是_______;
Ⅱ中x的值应为________。
[实验结论]实验所用两种金属氧化物中,催化效果最好的是_______。
②乙探究了影响双氧水分解速率的某种因素,实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2体积的装置是______(填编号)。
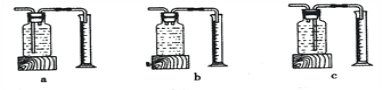
[实验结论]在相同条件下,_______,双氧水分解得越快。
[反思]丙用如图装置进行实验,通过比较_____也能达到实验目的。

【题目】对下列生活中的现象或做法解释不合理的是![]()
![]()
选项 | 现象或做法 | 解释 |
A | 湿衣服在阳光下比在阴凉处更易晾干 | 温度越高,分子运动越快 |
B | 油锅着火用锅盖盖灭 | 使可燃物与空气隔绝 |
C | 在食品袋内充入氮气 | 防止食物变质 |
D | 进入地窖前做灯火试验 | 防止 |
A. A B. B C. C D. D
【题目】海洋是地球上最大的储水库。蕴含着丰富的化学资源,开发前景十分远大:
(1)目前海水淡化普遍采取的方法是_____。
(2)海水晒盐能够得到粗盐,某兴趣小组同学选取一些粗盐样品,想制得较纯净的精盐,进行如下实验探究:
步骤一:除去泥沙等难溶性杂质、操作的主要步骤为溶解,过滤、_____,在最后一步中玻璃棒的作用为_____;
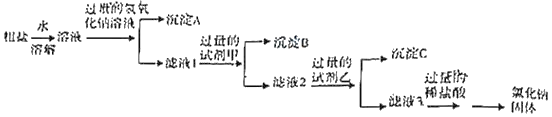
步骤二:除去步骤一所得粗盐中的可溶性杂质氯化镁、氯化钙、碳酸钠,采用如图所示流程:
写岀试剂甲溶液的溶质是_____,沉淀C的成分是_____;(均填化学式)
某同学通过对滤液3成份的检验与分折,确定杂质氯化镁、氯化钙、硫酸钠已被完全去除干净,设计实验方案如下:
实验操作步骤 | 实验现象 | 实验结论 |
步骤一:取少量滤液3于试管中,加入足量_____;过滤,向白色沉淀中加入过量稀硝酸 | 产生白色沉淀;白色沉淀全部溶解 | 证明滤液3中含有_____,没有氯化钙和硫酸钠 |
步骤二:向步骤一反应后所得滤溶液中加入无色酚酞 | 溶液变红 | 证明滤液中含有_____,没有氯化镁 |