��Ŀ����
����Ŀ�������ǵ��������Ĵ�ˮ�⡣�̺��ŷḻ�Ļ�ѧ��Դ������ǰ��ʮ��Զ��
��1��Ŀǰ��ˮ�����ձ��ȡ�ķ�����_____��
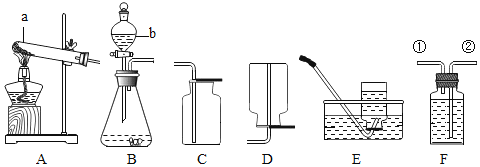
��2����ˮɹ���ܹ��õ����Σ�ij��ȤС��ͬѧѡȡһЩ������Ʒ�����Ƶýϴ����ľ��Σ���������ʵ��̽����
����һ����ȥ��ɳ�����������ʡ���������Ҫ����Ϊ�ܽ⣬���ˡ�_____�������һ���в�����������Ϊ_____��
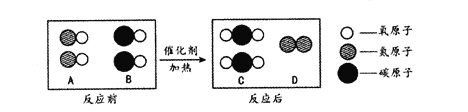
���������ȥ����һ���ô����еĿ����������Ȼ�þ���Ȼ��ơ�̼���ƣ�������ͼ��ʾ���̣�
д���Լ�����Һ��������_____������C�ijɷ���_____�������ѧʽ��
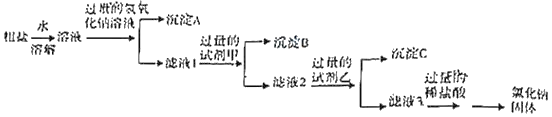
ijͬѧͨ������Һ3�ɷݵļ�������ۣ�ȷ�������Ȼ�þ���Ȼ��ơ��������ѱ���ȫȥ���ɾ������ʵ�鷽�����£�
ʵ��������� | ʵ������ | ʵ����� |
����һ��ȡ������Һ3���Թ��У���������_____�����ˣ����ɫ�����м������ϡ���� | ������ɫ��������ɫ����ȫ���ܽ� | ֤����Һ3�к���_____��û���Ȼ��ƺ������� |
�����������һ��Ӧ����������Һ�м�����ɫ��̪ | ��Һ��� | ֤����Һ�к���_____��û���Ȼ�þ |
���𰸡��༶�������� ���� ���裬��ֹ��ֲ��¶ȹ��ߣ����Һ�ηɽ� BaCl2 CaCO3��BaCO3 BaCl2 Na2CO3 NaOH��
��������
�⣺��1����ˮ�����ķ�����Ҫ�ǽ����ʳ�ȥ����ˮ���������ɣ�����Ŀǰ��ˮ�����ձ���õķ����Ƕ༶��������
��2������һ�������ᴿ�IJ������ܽ⣬���ˡ������������������в�����������Ϊ�����裬��ֹ��ֲ��¶ȹ��ߣ����Һ�ηɽ���
��������������ƺ��Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ��Ȼ����������Ʒ�Ӧ�������ᱵ�������Ȼ��ƣ�̼����Ӧ�÷����Ȼ����ĺ��棬���Գ�ȥ�������Ȼ������Ȼ��ƣ������Լ�����Һ��������BaCl2������C�ijɷ���CaCO3��BaCO3��
�Ȼ����������Ʒ�Ӧ�������ᱵ�������Ȼ��ƣ�������Һ��ʹ��̪���ɫ���������ƻ����Ȼ�þ��Ӧ����������þ����������
ʵ��������� | ʵ������ | ʵ����� |
����һ��ȡ������Һ3���Թ��У���������BaCl2�����ˣ����ɫ�����м������ϡ���� | ������ɫ��������ɫ����ȫ���ܽ� | ֤����Һ3�к���Na2CO3��û���Ȼ��ƺ������� |
�����������һ��Ӧ����������Һ�м�����ɫ��̪ | ��Һ��� | ֤����Һ�к���NaOH��û���Ȼ�þ |
��2������һ�����������裬��ֹ��ֲ��¶ȹ��ߣ����Һ�ηɽ���
�������BaCl2��CaCO3��BaCO3��
ʵ��������� | ʵ������ | ʵ����� |
����һ��ȡ������Һ3���Թ��У���������BaCl2�����ˣ����ɫ�����м������ϡ���� | ������ɫ��������ɫ����ȫ���ܽ� | ֤����Һ3�к���Na2CO3��û���Ȼ��ƺ������� |
�����������һ��Ӧ����������Һ�м�����ɫ��̪ | ��Һ��� | ֤����Һ�к���NaOH��û���Ȼ�þ |

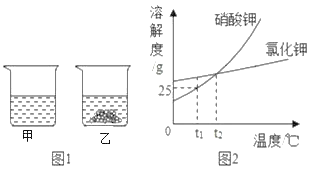
����Ŀ����ͼ��ʾ���ڷֱ�ʢ��100gˮ���ձ��з���KNO3����ܽ⣬��˵����ȷ���ǣ�������
�¶ȣ��棩 | t1 | t2 |
KNO3���ܽ�ȣ�g/100gˮ�� | 60 | 90 |
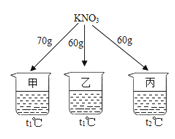
A. �ҡ�����Һ�������������
B. ��������t2�棬��Һ��������
C. �ס��һ�Ϻ�Ϊt1��IJ�������Һ
D. ��������t1�棬�о�������