题目内容
【题目】Fe2O3俗称铁红,常用作红色涂料,也可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2Fe2O3+C![]() 4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,得到211 kg固体混合物,按上述原理充分反应后固体混合物的质量变为200 kg。请计算:
4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,得到211 kg固体混合物,按上述原理充分反应后固体混合物的质量变为200 kg。请计算:
(1)Fe2O3中铁元素与氧元素的质量比_____________。
(2)生成二氧化碳的质量________。
(3)反应后固体混合物中FeO的质量分数_________。
【答案】7:3 11 kg 36%
【解析】
根据氧化铁的化学式计算对应的质量比,进而根据质量变化为生成的二氧化碳的质量,结合二氧化碳的质量和对应的化学方程式求算混合物中氧化亚铁的质量分数。
解:(1)Fe2O3中铁元素与氧元素的质量比(56×2):(16×3)=7:3;
(2)由题意可知,生成的CO2的质量为211kg-200kg=11kg;
(3)设生成的FeO质量为x,

![]()
x=72kg,
反应后固体混合中FeO的质量分数为:![]() ×100%=36%;
×100%=36%;
答:(1)Fe2O3中铁元素与氧元素的质量比7:3;
(2)生成二氧化碳的质量为11kg;
(3)反应后固体混合物中FeO的质量分数为36%。

练习册系列答案
相关题目
【题目】如图所示,在分别盛有100g水的烧杯中放入KNO3充分溶解,则说法正确的是( )
温度(℃) | t1 | t2 |
KNO3的溶解度(g/100g水) | 60 | 90 |
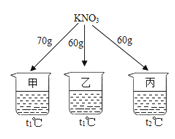
A. 乙、丙溶液中溶质质量相等
B. 乙升温至t2℃,溶液质量增加
C. 甲、乙混合后为t1℃的不饱和溶液
D. 丙降温至t1℃,有晶体析出