题目内容
【题目】如图是CO还原氧化铁的实验装置。取2.09氧化铁粉末进行实验,(已知: 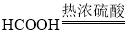
![]() )实验结束后称得装置中剩余固体质量为1 .6g。下列说法正确的是
)实验结束后称得装置中剩余固体质量为1 .6g。下列说法正确的是
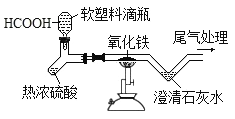
A.反应产生的CO中会含有较多的水蒸气
B.浓硫酸在本实验中只应用了它的吸水性
C.反应结束后的剩余的1.6g固体是混合物
D.澄清石灰水是为了吸收多余的一氧化碳
【答案】C
【解析】
A、浓硫酸有吸水性,所以反应产生的CO中会含有较少的水蒸气,故错误;
B、浓硫酸在甲酸分解反应中起脱水作用,故错误;
C、一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,氧化铁中铁元素的质量为2.09g×![]() ×100%=1.46g,实验结束后称得装置中剩余固体质量为1 .6g,说明氧化铁有剩余,故正确;
×100%=1.46g,实验结束后称得装置中剩余固体质量为1 .6g,说明氧化铁有剩余,故正确;
D、澄清石灰水变浑浊,说明有二氧化碳生成,从而说明一氧化碳与氧化铁发生了反应,故错误。
故选C。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】碳酸钠是重要的化工原料。吕布兰、索尔维和侯德榜为它的工业化生产作出了巨大贡献。
Ⅰ、吕布兰法:1789年,法国医生吕布兰(N. Leblanc, 1742 -1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图:
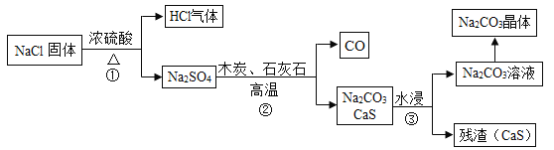
(1)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为____;
(2)③中”水浸”时通常需要搅拌,其目的是____;
(3)吕布兰法有明显不足,不断有科学家进行改进,请写出该法不足之处__(一处即可)。
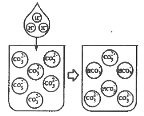
II、索尔维法: 1892 年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:
![]()
![]()
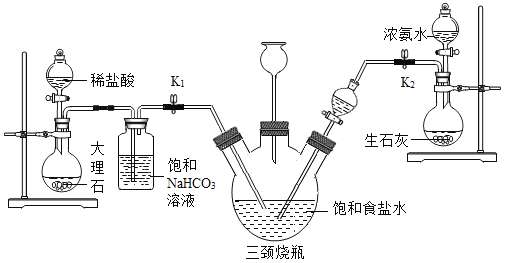
某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。实验操作如下:
①关闭K1,打开K2,通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭 K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(4)三颈烧瓶上连接的长颈漏斗的主要作用是_______,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______;关闭K2停止通NH3后,还要继续通CO2一段时间,其目的是_______;
(5)根据实验记录,计算t2时NaHCO3固体的分解率为______( 已分解的NaHCO3质量与加热前原NaHCO3质量的比值)。
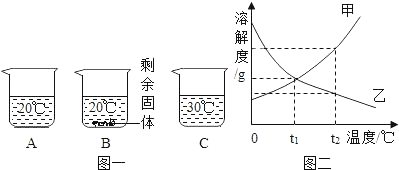
【题目】某同学设计如下几组实验,探究盐酸的性质。
(第一组)选取3种溶液,2种固体,如下图所示进行实验。
实验 | 现象及结论 | 解释 |
| (1)试管A中产生______(填实验现象)。发生的反应类型是____。 | |
试管B可观察到铜丝外面的黑色逐渐消失。 | (2)试管B中增加的离子是__(填离子符号)。 | |
试管C中有气泡产生。复分解反应已发生。 | (3)反应的化学方程式为____。 |
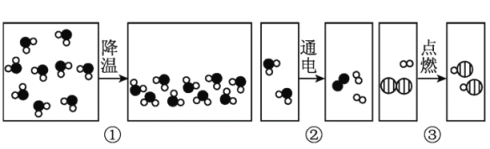
(第二组)对试管D中盐酸和氢氧化钙是否发生反应进行探究。如下图所示进行实验。
实验 | 现象及结论 | 解释 |
| 有白色沉淀产生,证明氢氧化钙溶液和稀盐酸的反应已发生。 | (4)你认为这个实验设计是否合理______,原因是_____。 |
通过测定D试管反应前后溶液的pH变化,确定发生反应。 | ||
结论 | 氢氧化钙和盐酸能发生反应 | |
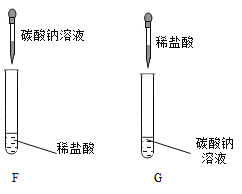
(第三组)对碳酸钠和稀盐酸的反应本质继续探究。如下图所示进行实验。
实验 | 现象及结论 | 解释 |
| 试管F中立刻有较多气泡产生。试管G中开始只有极少量气泡,一段时间后有较多气泡产生。 |
(5)试管G中一开始气泡很少的原因是____。 |
结论:盐酸能与铁、氧化铜、氢氧化钙、碳酸钠发生化学反应