题目内容
【题目】碳酸钠是重要的化工原料。吕布兰、索尔维和侯德榜为它的工业化生产作出了巨大贡献。
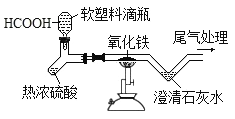
Ⅰ、吕布兰法:1789年,法国医生吕布兰(N. Leblanc, 1742 -1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图:
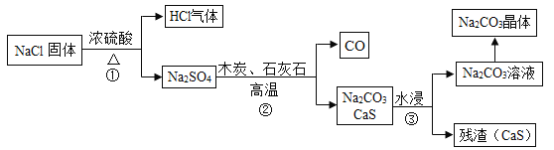
(1)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为____;
(2)③中”水浸”时通常需要搅拌,其目的是____;
(3)吕布兰法有明显不足,不断有科学家进行改进,请写出该法不足之处__(一处即可)。
II、索尔维法: 1892 年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:
![]()
![]()
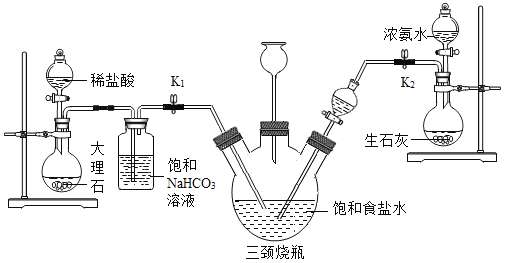
某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。实验操作如下:
①关闭K1,打开K2,通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭 K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(4)三颈烧瓶上连接的长颈漏斗的主要作用是_______,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______;关闭K2停止通NH3后,还要继续通CO2一段时间,其目的是_______;
(5)根据实验记录,计算t2时NaHCO3固体的分解率为______( 已分解的NaHCO3质量与加热前原NaHCO3质量的比值)。
【答案】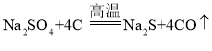 加快碳酸钠的溶解速度 产生有毒的一氧化碳气体,污染环境(或者高能耗等其他合理答案) 平衡压强 吸收过量的氨气 使氨气、氯化钠等充分反应 50%
加快碳酸钠的溶解速度 产生有毒的一氧化碳气体,污染环境(或者高能耗等其他合理答案) 平衡压强 吸收过量的氨气 使氨气、氯化钠等充分反应 50%
【解析】
I、吕布兰法:向氯化钠固体中加入浓硫酸并加热,得到氯化氢气体和硫酸钠溶液,再向硫酸钠溶液中加入木炭和石灰石,高温加热,硫酸钠和木炭反应生成硫化钠和一氧化碳,硫化钠再和碳酸钙反应生成硫化钙和碳酸钠,经过水浸得到碳酸钠溶液,再蒸发结晶得到纯碱。
II、①关闭K1,打开K2,通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;氨气、二氧化碳和氯化钠反应即可得到碳酸氢钠晶体,再过滤、洗涤、低温干燥,并将碳酸氢钠晶体置于敞口容器中加热,碳酸氢钠分解生成碳酸钠。
(1)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为: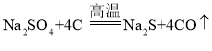 ;
;
(2)③中”水浸”时通常需要搅拌,目的是加快碳酸钠的溶解速度;
(3)吕布兰法有明显不足,例如会产生有毒的一氧化碳气体,污染环境;
(4)三颈烧瓶上连接的长颈漏斗的主要作用是平衡压强,保证氨气和二氧化碳顺利通入三颈烧瓶;在长颈漏斗内放置一团蘸有酸液的棉花是为了吸收过量的氨气,防止污染空气;关闭K2停止通NH3后,还要继续通 CO2一段时间,使氨气、氯化钠等充分反应;
(5)碳酸氢钠分解生成碳酸钠、二氧化碳和水,t5时,固体质量不变,所以固体都是碳酸钠,设起始碳酸氢钠的质量为x
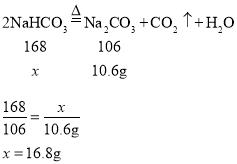
则起始碳酸氢钠的质量为16.8g;t2时,固体质量减少了16.8g-13.7g=3.1g,t5时,固体质量减少了16.8g-10.6g=6.2g,所以t2时固体正好减少了一半,说明碳酸氢钠分解了一半,则碳酸氢钠的分解率为50%。