题目内容
【题目】某同学设计如下几组实验,探究盐酸的性质。
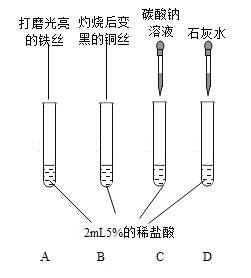
(第一组)选取3种溶液,2种固体,如下图所示进行实验。
实验 | 现象及结论 | 解释 |
| (1)试管A中产生______(填实验现象)。发生的反应类型是____。 | |
试管B可观察到铜丝外面的黑色逐渐消失。 | (2)试管B中增加的离子是__(填离子符号)。 | |
试管C中有气泡产生。复分解反应已发生。 | (3)反应的化学方程式为____。 |
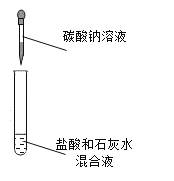
(第二组)对试管D中盐酸和氢氧化钙是否发生反应进行探究。如下图所示进行实验。
实验 | 现象及结论 | 解释 |
| 有白色沉淀产生,证明氢氧化钙溶液和稀盐酸的反应已发生。 | (4)你认为这个实验设计是否合理______,原因是_____。 |
通过测定D试管反应前后溶液的pH变化,确定发生反应。 | ||
结论 | 氢氧化钙和盐酸能发生反应 | |
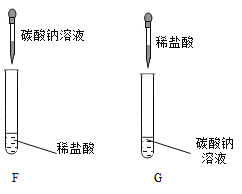
(第三组)对碳酸钠和稀盐酸的反应本质继续探究。如下图所示进行实验。
实验 | 现象及结论 | 解释 |
| 试管F中立刻有较多气泡产生。试管G中开始只有极少量气泡,一段时间后有较多气泡产生。 |
(5)试管G中一开始气泡很少的原因是____。 |
结论:盐酸能与铁、氧化铜、氢氧化钙、碳酸钠发生化学反应
【答案】有气泡冒出,溶液由无色变浅绿色 置换反应 Cu2+ ![]() 不合理 氢氧化钙和碳酸钠反应也生成碳酸钙沉淀 当稀盐酸较少时,与碳酸钠反应会生成碳酸氢钠,再加入盐酸后与碳酸氢钠反应生成二氧化碳
不合理 氢氧化钙和碳酸钠反应也生成碳酸钙沉淀 当稀盐酸较少时,与碳酸钠反应会生成碳酸氢钠,再加入盐酸后与碳酸氢钠反应生成二氧化碳
【解析】
(1)铁和稀盐酸反应生成氯化亚铁和氢气,反应现象为有气泡冒出,溶液由无色变红浅绿色,此反应属于置换反应;
(2)氧化铜和盐酸反应生成氯化铜和水,反应后生成了铜离子,符号为Cu2+;
(3)碳酸钠和盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式:![]() ;
;
(4)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以该实验设计不合理;
(5)当稀盐酸较少时,与碳酸钠反应会生成碳酸氢钠,再加入盐酸后与碳酸氢钠反应生成二氧化碳,所以开始时,产生的气泡较少。

 阅读快车系列答案
阅读快车系列答案