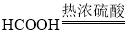题目内容
【题目】(1)二氧化氮进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对 含有二氧化氮的废气进行处理。
①可以用 NaOH 溶液吸收:反应的化学方程式如下:2NO2+2NaOH==NaNO2+NaNO3+X,则 X 的化学式 为_______________ 。
②配制 200Kg 溶质质量分数为 5%的 NaOH 溶液,需要溶质质量分数为 20%的 NaOH 溶液___________ Kg,需要加水________________Kg。
(2)某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得 烧杯中溶液 pH 的变化如图所示。

①经测定 a 点溶液中的溶质为 __________ 、__________(填化学式)。
②写出b点硫酸和氢氧化钠溶液反应的化学方程式__________。
③取 c 点溶液蒸发得到二种盐,它们是硫酸钠和硫酸氢钠。现若将 15g10%的硫酸氢钠溶液和 10g10% 的氢氧化钡溶液混合,请你写出该反应的化学方程式______________ 。
【答案】H2O 50 150 Na2SO4 NaOH H2SO4+2NaOH=Na2SO4+2H2O 2NaHSO4+Ba(OH)2=Na2SO4+BaSO4↓+2H2O
【解析】
(1)①可以用 NaOH 溶液吸收:反应的化学方程式如下:2NO2+2NaOH=NaNO2+NaNO3+X,根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物比生成物多2个氢原子和1个氧原子,故 X 的化学式为:H2O;
②配制 200kg 溶质质量分数为 5%的 NaOH 溶液,需要溶质质量分数为20%的NaOH 溶液=![]() ,需要加水的质量=200kg-50kg=150kg。
,需要加水的质量=200kg-50kg=150kg。
(2)①氢氧化钠与硫酸反应产生硫酸钠溶液,a点时,溶液显碱性,一定有氢氧化钠,经测定a 点溶液中的溶质为:Na2SO4和NaOH。
②b点硫酸和氢氧化钠溶液反应产生硫酸钠和水的化学方程式:H2SO4+2NaOH=Na2SO4+2H2O。
③取 c 点溶液蒸发得到二种盐,它们是硫酸钠和硫酸氢钠。现若将 15g10%的硫酸氢钠溶液和 10g10% 的氢氧化钡溶液混合;
15g 10%的硫酸氢钠溶液中氢离子的质量为15g×10%×![]() ;
;
10g 10%的氢氧化钡溶液中氢氧根的质量为10g×10%×![]() ;
;
设:与0.0125g氢离子恰好完全反应时,需要氢氧根的质量为x;
氢离子与氢氧根反应产生水的关系如下:
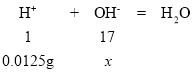
![]() x=0.2125g,大于0.199g,两溶液反应硫酸氢钠过量,则硫酸氢钠与氢氧化钡反应反应产生硫酸钠、硫酸钡沉淀和水的化学方程式:2NaHSO4+Ba(OH)2=Na2SO4+BaSO4↓+2H2O。
x=0.2125g,大于0.199g,两溶液反应硫酸氢钠过量,则硫酸氢钠与氢氧化钡反应反应产生硫酸钠、硫酸钡沉淀和水的化学方程式:2NaHSO4+Ba(OH)2=Na2SO4+BaSO4↓+2H2O。