题目内容
【题目】某工厂要测定硫酸厂的废水中硫酸的含量(假设废水中其他物质的水溶液显中性,且不与其他物质发生反应)请回答下列问题:
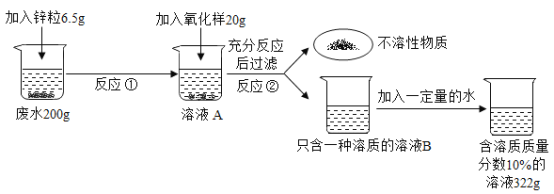
(1)写出反应②中发生反应的化学方程式_____;
(2)根据已知条件列出反应①中参加反应的硫酸质量(x的比例式)_____;
(3)溶液A中溶质的化学式______;
(4)废水中硫酸的质量分数是______;
(5)为了得到含溶质质量分数为10%的溶液322g,需要加水的质量为_____;
(6)工厂要回收最终溶液中的溶质,在蒸发操作过程中所用到的仪器有:铁架台、酒精灯、_____。
【答案】ZnO+H2SO4=ZnSO4+H2O ![]() H2SO4、ZnSO4 9.8% 107.6g 蒸发皿、玻璃棒
H2SO4、ZnSO4 9.8% 107.6g 蒸发皿、玻璃棒
【解析】
根据加入20克氧化锌,充分反应后过滤,得到只含有一种溶质的溶液B,溶液B是硫酸锌溶液,同时可知,6.5克锌已完全反应,硫酸有剩余,再加20克氧化锌与剩余的硫酸反应,反应后由不溶性固体剩余说明氧化锌有剩余。
(1)氧化锌和硫酸反应生成硫酸锌和水,反应的化学方程式为:ZnO+H2SO4=ZnSO4+H2O;
(2)设与锌反应的硫酸的质量为x,则:
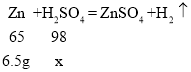
![]() ,
,
(3)由上分析可知锌和硫酸反应生成硫酸锌和氢气,硫酸有剩余;在溶液A中又加入20克氧化锌与剩余的硫酸反应有不溶性物质剩余,说明氧化锌过量,硫酸完全反应,所以溶液A中含有硫酸、硫酸锌;
(4)设废水中硫酸的质量为y,根据
ZnO+H2SO4=ZnSO4+H2O,Zn+H2SO4=ZnSO4+H2![]() ,
,
可得如下关系:
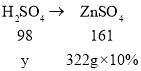
![]()
y=19.6g,
则废水中硫酸的质量分数是:![]() ;
;
(5)设锌和硫酸反应生成氢气的质量为m,生成硫酸锌的质量为n,则:
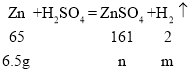
![]() m=0.2g,
m=0.2g,
![]() n=16.1g,
n=16.1g,
设参加反应的氧化锌的质量为a,则:
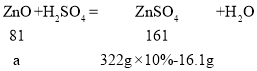
![]() a=8.1g,
a=8.1g,
反应后所得溶液B的质量=6.5g+200g+20g-(20g-8.1g)-0.2g=214.4g,需要加水的质量=322g-214.4g=107.6g,
(6)蒸发操作过程中所用到的仪器有:铁架台、酒精灯、蒸发皿、玻璃棒。

 阅读快车系列答案
阅读快车系列答案【题目】葡萄糖是生命体所需能量的主要来源。
(提出问题)葡萄糖的燃烧产物是CO2和H2O,由此能否证明:葡萄糖只由碳元素和氢元素组成的有机物?
(实验设计)为了确定葡萄糖的元素组成,某小组设计了如图的实验流程(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略)。
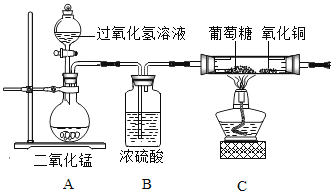
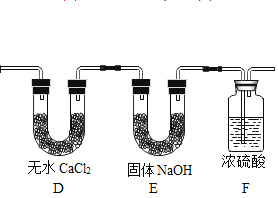
(1)装置B中浓硫酸的作用是__________________。
(2)装置C处氧化铜的作用是_________________。
(方案评价)
(1)用充有空气的储气球代替装置A,是否更有利于实验的进行?________(填“是”或“否”)原因是______________。
(2)装置D和E______________(填“能”或“不能”)对调,原因是_____________。
(数据处理)下表3是同学们填写的实验报告,请你帮助完成。
实验事实 | 数据分析及结论 |
1.8g葡萄糖完全燃烧,得到2.64g CO2和1.08g H2O | 数据___________ 结论:葡萄糖含有C、H、O三种元素 |
(讨论交流)为了尽量减少误差:
(1)该实验在进行过程中应注意的问题是________________(写1条)。
(2)从定量实验的角度看,该实验是否可进一步改进?请简要写出一个改进意见:___________。
【题目】2012年1月,广西河池宜州市境内龙江河发生了镉浓度超标事件。根据该事件某化学活动小组开展了一次关于金属镉与铜、银活动性顺序的探究及镉污染事故处理方法的研讨活动。
查阅资料:①镉(Cd)是一种银白色金属,在化合物中通常表现为+2价 ②水体中镉元素通常以氯化镉的形式存在 ③氯化镉能溶于水,氢氧化镉难溶于水
(一)金属镉与铜、银活动性顺序的探究
实验步骤 | 实验现象 | 实验结论 |
取适量镉、铜、银于试管中,加入足量 | 镉表面有气泡产生,铜、银表面无气泡产生 | 镉的活动性顺序大于铜与银 |
取适量铜于试管中,加入少量硝酸银溶液 | , | 铜的活动性顺序大于银 |
实验结论:活动性顺序:镉>铜>银
(二)对镉污染事故处理方法的讨论
小聪认为可用向受污染河段抛撒过量烧碱固体的方法除去氯化镉,反应原理用化学方程式表示为 。小敏认为该方案虽然有效,但有缺陷,原因是 。受小聪与小敏启发,你认为可以用 (写俗称)代替烧碱。
【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如右图),为确认其中的溶质,同学们进行了如下的探究活动。请你参与到其中去,回答有关问题。

【进行猜想】猜想Ⅰ:该溶液的溶质是NaCl;
猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;
猜想IV:该溶液的溶质是NaHCO3.
【查阅资料】常温下物质的相关信息如下表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,该溶液的溶质不是NaHCO3,因为常温下NaHCO3溶液溶质的质量分数最大是
(精确到01.%)。
【进行实验】
(1)测定溶液的pH大于7,该溶液的溶质不是 (填化学式)。
(2)同学们又进行了如下实验,实验过程如下:

①产生白色沉淀的化学方程式是 。
②实验可以判断原无色溶液中含有的溶质有 。
【获得结论】
该瓶原来装的无色溶液的溶质是NaOH,并且 (填“没有”、“部分”或“全部”)变质。
【拓展】
提纯该无色溶液的步骤是:先向无色溶液中加入适量的 ,然后过滤。反应化学方程式是 。