题目内容
【题目】在2019年9月22日闭幕的第十届亚洲机器人锦标赛中国选拔赛北大区赛中,我校初、高中部学子奋力拼搏,最终拿下了VEX-IQ、VEX-EDR竞赛项目的2金4银13铜的好成绩。

(1)某些机器人的外壳采用的材料是硬铝,硬铝属于_____材料,该材料具有的优点是____(填序号)。
A 强度和硬度好
B 抗腐蚀性好、 密度大
C 韧性好和硬度小
(2)机器人工作时常采用锂电池组,该电池的工作原理为Li+MnO2=LiMnO2的氧化还原反应,反应前后锰元素的化合价变化为______,该电池组充电时的能量转化为______。
【答案】金属 A +4(价)变为+3(价) 电能转化为化学能
【解析】
(1)硬铝属于是合金,属于金属材料,硬铝具有强度和硬度好、抗腐蚀性好、密度较小的优点;
(2)二氧化锰中氧元素为-2价,根据化合物中各元素化合价代数和为零可以求出锰元素的化合价为+4价;LiMnO2中氧元素为-2价、Li元素为+1价可以求出锰元素的化合价为+3价;使用时化学能转化成电能。

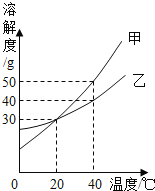
【题目】下表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题.
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
(1)从表中数据可以获得的信息是__________(写一条).
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是__________,此时溶液的溶质质量分数为__________.(保留一位小数)
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:

(Ⅰ)步骤②中加入过量Ca(OH)2的目的是__________;涉及反应的化学方程式为__________.
(Ⅱ)滤液B中的溶质是__________(写化学式);步骤③所包含的具体操作是加热浓缩、__________、过滤.
(Ⅲ)若实验前称得样品的质量为10g,实验后称得“滤渣A”和“NaOH固体”的质量分别是5g和8.7g,则此样品的纯度为__________.