题目内容
【题目】空气的主要成分是氧气和氮气。
(1)空气属于________(填“混合物”或“纯净物”)。
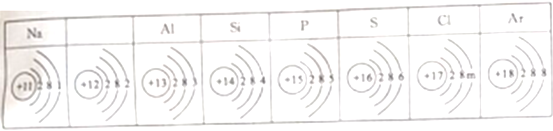
(2)用“”表示氮原子,“●”表示氧原子。
①用“![]() ”可表示的微粒是______(填名称)。
”可表示的微粒是______(填名称)。
②同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,如图可表示空气微观模型的是____(填标号)。

(3)下图是氧元素在元素周期表中的信息及微粒结构示意图。
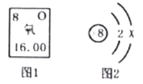
①从图1中可获得多条信息,其一是__________。
②若图2中表示氧原子,在化学反应中,氧原子容易______(填“得”或“失”)电子。
③若图2中,x=8时,该微粒是_________(写微粒符号)。
(4)以下是利用空气制取氮肥过程中重要的一步化学反应微观示意图。
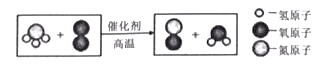
①该反应的化学方程式是________。
②物质所含元素化合价发生变化的反应属于氧化还原反应。该反应_______(填“属于”或“不属于”)氧化还原反应。
【答案】 混合物 氮分子 C 氧的相对原子质量为16.00 得 O2- 4NH3+5O2![]() 4NO+6H2O 属于
4NO+6H2O 属于
【解析】(1)空气中含有氧气、氮气、二氧化碳等物质,属于混合物;
(2)①分子是由原子构成的,用“![]() ”可表示的微粒是氮分子;
”可表示的微粒是氮分子;
②同温同压下,气体的体积比等于分子数目比。氧气约占空气体积的1/5,若空气中其它成分忽略不计,微观上氮分子与氧分子的个数比为4:1,图中可表示空气微观模型的是C;
(3)①元素周期表中包含信息较多,例如氧的相对原子质量为16.00、氧元素的元素符号为O、质子数为8等;
②氧原子的最外层电子数是6,可知氧原子在化学反应中容易得到两个电子形成稳定结构;
③若图2中,x=8时,电子数=2+8=10>质子数=8,该微粒是离子,可表示为:O2-;
(4)①由微观示意图可知,反应是氨气和氧气在高温和催化剂的作用下生成一氧化氮和水,其反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
②氮元素反应前化合价为-3价,反应后化合价为+2价,氧元素反应前化合价为0价,反应后化合价为-2价,属于氧化还原反应。

【题目】某实验小组利用废硫酸液制备K2SO4并研究CaSO42H2O加热分解的产物。
(一)K2SO4的制备
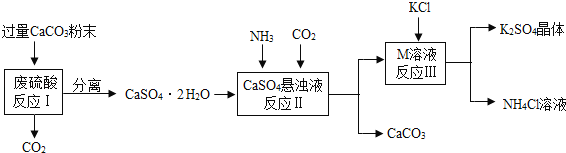
(1)将CaCO3研成粉末的目的是___________________________________。
(2)M物质的化学式为__________。
(3)反应Ⅲ中相关物质的溶解度如下表。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下能实现的原因是_______________________________________。
(4)上述流程中可循环使用的物质有CO2和_____________(填写化学式)。
(二)研究CaSO42H2O加热分解的产物
(5)分离出的CaSO42H2O中常含有CaCO3,可用盐酸除去CaCO3,
该反应的化学方程式_______________________________________________。
(6)为了测定CaSO42H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验。注:碱石灰的主要成分为NaOH和CaO。
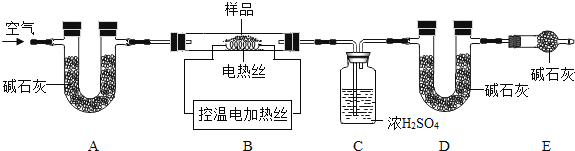
① 实验前首先要________________,再装入样品。装置A的作用是_________________。
② 已知:CaSO42H2O在160℃生成CaSO4,1350℃时CaSO4开始分解; CaCO3在900℃时分解完全。
现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将______。(填“偏大”、“偏小”或“无影响”)你认为还可选用上述的________________(选填序号)两个数据组合也可求出x:y的值。
(7)CaSO42H2O受热会逐步失去结晶水。取纯净CaSO42H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示。
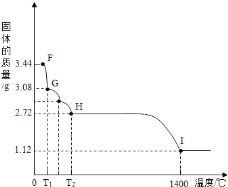
则G点固体的化学式是_________________。