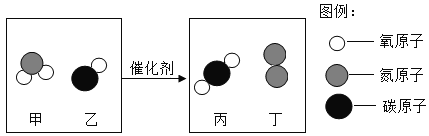
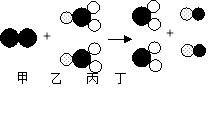
题目内容
【题目】下列叙述不符合质量守恒定律的是
A.在空气中加热 6.4g 铜,生成氧化铜的质量为 8g
B.取 20 克石灰石于烧杯中再向其中加入 50 克稀盐酸恰好完全反应,反应后烧杯中物质总质量为 66.7克
C.1g 氢气与 1g 氧气恰好反应可生成 2g 水
D.32g 硫与 32g 氧气恰好反应可生成 64g 二氧化硫
【答案】C
【解析】
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和。
A、铜和氧气完全反应的质量比为![]() ,在空气中加热6.4g铜,消耗1.6g氧气,生成氧化铜的质量为
,在空气中加热6.4g铜,消耗1.6g氧气,生成氧化铜的质量为![]() ,符合质量守恒定律,故A正确;
,符合质量守恒定律,故A正确;
B、石灰石中的碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,20克石灰石于烧杯中再向其中加入50克稀盐酸恰好完全反应,反应后烧杯中物质总质量为 66.7克,质量减少,是生成了二氧化碳气体,符合质量守恒定律,故B正确;
C、氢气与氧气恰好完全反应的质量比为![]() ,1g 氢气与8g氧气恰好完全反应,1g 氢气与 1g 氧气反应,氢气有剩余,不能生成 2g水,不符合质量守恒定律,故C不正确;
,1g 氢气与8g氧气恰好完全反应,1g 氢气与 1g 氧气反应,氢气有剩余,不能生成 2g水,不符合质量守恒定律,故C不正确;
D、硫和氧气恰好完全反应的质量比为![]() ,32g硫与32g氧气恰好反应可生成 64g 二氧化硫,符合质量守恒定律,故D正确。故选C。
,32g硫与32g氧气恰好反应可生成 64g 二氧化硫,符合质量守恒定律,故D正确。故选C。

练习册系列答案
相关题目
【题目】实验室制气体常见仪器如下图所示。
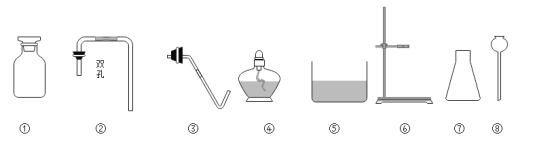
A | B |
用过氧化氢溶液与二氧化锰制氧气。 (1)反应的化学方程式为_____。 (2)组装发生装置应选择的仪器为_____(填序号)。 | 用加热高锰酸钾的方法制氧气 (1)反应的化学方程式为_____。 (2)需要补充的一种仪器是_____。 |