题目内容
【题目】实验是学习化学的重要途径,小亮在学习酸碱盐的化学性质时做了如下实验,请你和他一起完成实验活动.
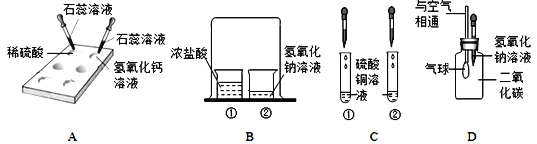
(1)在白色点滴板上完成实验A,请将实验现象补充完整.
稀硫酸 | 氢氧化钙溶液 | |
实验现象 | __________ | 溶液变蓝色 |
(2)在实验B的烧杯②中滴加2滴酚酞溶液后,扣上大烧杯,一段时间后看到的现象是_________,得出的结论是________。
(3)在实验C的试管①中,滴加少量的氢氧化钠溶液,看到的现象是________,反应的化学方程式是__________.要使试管②中产生白色沉淀,应滴加_________溶液(写化学式)。
(4)小亮用实验D验证二氧化碳与氢氧化钠溶液反应,看到的现象是_______。
【答案】溶液变红色 氢氧化钠溶液由红色变成无色 浓盐酸具有挥发性,酸碱会发生中和反应 有蓝色沉淀生成 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 氯化钡 气球胀大
【解析】
(1)紫色石蕊遇酸变红色,遇碱变蓝色;
(2)碱能使酚酞变红色,浓盐酸具有挥发性,所以一段时间后看到的现象是:氢氧化钠溶液由红色变成无色,得出的结论是浓盐酸具有挥发性,酸碱会发生中和反应;
(3)氢氧化钠和硫酸铜反应会生成氢氧化铜沉淀,看到的现象是:有蓝色沉淀生成,化学方程式为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,硫酸根离子和钡离子反应会使白色的硫酸钡沉淀,要使试管②中产生白色沉淀,应滴加氯化钡溶液;
(4)氢氧化钠会与二氧化碳反应,导致集气瓶内的气压减小,所以看到的现象是气球胀大。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】掌握科学的研究方法,探索化学世界的奥秘。
(1)分类是学习化学的重要方法之一,生活中,常会接触到下列物质:
A 钢丝 B 甲烷 C 生石灰 D 碘酒
其中属于混合物的是_____(填字母,下同),属于氧化物的是_____。
(2)实验室中可用KClO3在MnO2催化下受热分解制取氧气,化学方程式为_____,将反应后的混合物进行分离。实验操作如图所示:
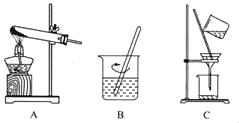
①图A中试管口略向下倾斜的原因是_____;
图B操作中玻璃棒的作用是_____;
图C操作中的一处明显错误是_____。
(3)质量守恒定律是帮助我们认识化学反应实质的重要理论。①下列表述正确的是_____。
A 蜡烛燃烧后质量减少,说明质量守恒定律不是普遍规律
B 每32gS和32gO2完全反应后,生成64gSO2
C 在化学反应aA+bB═cC+dD中一定有:a+b=c+d
②化合物R与足量氧气置于密闭容器中充分反应生成CO2和H2O,实验测得反应前后物质的质量如表:
R | O2 | CO2 | H2O | |
反应前质量/g | 46 | 128 | 0 | 0 |
反应后质量/g | 0 | 32 | x | 54 |
若参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是_____。