题目内容
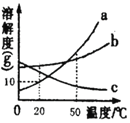
【题目】在用氢氧化钠溶液和溶质质量分数为7.3%的稀盐酸进行中和反应实验时,反应过程中溶液酸碱度变化及相关数据如图所示。
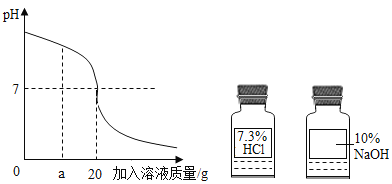
(1)根据此变化曲线,你认为实验操作是将_____________滴加到另一种溶液中。
(2)当加入溶液的质量是a克时,滴入无色酚酞试液,溶液呈___色,此时溶液中溶质是_________(写化学式)
(3)求恰好完全反应后所得溶液中溶质的质量(需写出计算过程)_________
【答案】稀盐酸 红色 NaOH、NaCl 2.34g
【解析】
(1)根据开始时溶液的pH大于7,可以判断出是将盐酸滴加氢氧化钠溶液中;
(2)根据溶液的pH大于7呈碱性进行解答;
(3)当溶液的pH等于7时,说明恰好完全反应,根据加入盐酸的量求出溶质的质量。
解:(1)由图中pH值的变化看出,pH值由大于7→等于7→小于7,应是将稀盐酸滴加到氢氧化钠溶液中;
(2)当加入溶液的质量是a克时,pH大于7,溶液显碱性,滴入无色酚酞试液,显红色,溶液中的溶质是:NaOH、NaCl;
(3)设生成氯化钠质量为x,观察图象知恰好完全反应时消耗HCl的质量:20g×7.3%=1.46g;
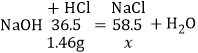
![]()
x=2.34g;
答:恰好完全反应时溶液中溶质的质量为2.34g。

 口算题天天练系列答案
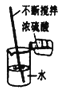
口算题天天练系列答案【题目】实验是学习化学的重要途径,小亮在学习酸碱盐的化学性质时做了如下实验,请你和他一起完成实验活动.
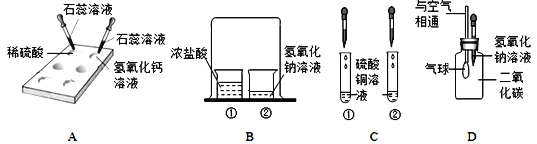
(1)在白色点滴板上完成实验A,请将实验现象补充完整.
稀硫酸 | 氢氧化钙溶液 | |
实验现象 | __________ | 溶液变蓝色 |
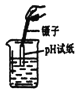
(2)在实验B的烧杯②中滴加2滴酚酞溶液后,扣上大烧杯,一段时间后看到的现象是_________,得出的结论是________。
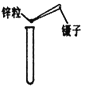
(3)在实验C的试管①中,滴加少量的氢氧化钠溶液,看到的现象是________,反应的化学方程式是__________.要使试管②中产生白色沉淀,应滴加_________溶液(写化学式)。
(4)小亮用实验D验证二氧化碳与氢氧化钠溶液反应,看到的现象是_______。