题目内容
【题目】掌握科学的研究方法,探索化学世界的奥秘。
(1)分类是学习化学的重要方法之一,生活中,常会接触到下列物质:
A 钢丝 B 甲烷 C 生石灰 D 碘酒
其中属于混合物的是_____(填字母,下同),属于氧化物的是_____。
(2)实验室中可用KClO3在MnO2催化下受热分解制取氧气,化学方程式为_____,将反应后的混合物进行分离。实验操作如图所示:
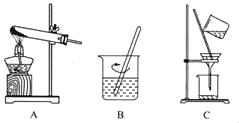
①图A中试管口略向下倾斜的原因是_____;
图B操作中玻璃棒的作用是_____;
图C操作中的一处明显错误是_____。
(3)质量守恒定律是帮助我们认识化学反应实质的重要理论。①下列表述正确的是_____。
A 蜡烛燃烧后质量减少,说明质量守恒定律不是普遍规律
B 每32gS和32gO2完全反应后,生成64gSO2
C 在化学反应aA+bB═cC+dD中一定有:a+b=c+d
②化合物R与足量氧气置于密闭容器中充分反应生成CO2和H2O,实验测得反应前后物质的质量如表:
R | O2 | CO2 | H2O | |
反应前质量/g | 46 | 128 | 0 | 0 |
反应后质量/g | 0 | 32 | x | 54 |
若参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是_____。
【答案】AD C 2KClO3![]() 2KCl+3O2↑ 防止冷凝水回流炸裂试管 加快溶解 漏斗末端没有紧靠烧杯内壁 B 46
2KCl+3O2↑ 防止冷凝水回流炸裂试管 加快溶解 漏斗末端没有紧靠烧杯内壁 B 46
【解析】
(1)A.钢丝主要成分是铁,还含有碳等物质,是混合物;
B.甲烷是由一种物质组成的,是纯净物;
C.生石灰是由氧元素和钙元素组成的化合物,是氧化物;
D.碘酒中含有酒精和碘,是混合物。
故填:AD;C。
(2)实验室中可用KClO3在MnO2催化下受热分解生成氯化钾和氧气,化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
①图A中试管口略向下倾斜的原因是防止冷凝水回流炸裂试管;
图B操作中玻璃棒的作用是加快溶解;
图C操作中的一处明显错误是漏斗末端没有紧靠烧杯内壁。
故填:2KClO3![]() 2KCl+3O2↑;防止冷凝水回流炸裂试管;加快溶解;漏斗末端没有紧靠烧杯内壁。
2KCl+3O2↑;防止冷凝水回流炸裂试管;加快溶解;漏斗末端没有紧靠烧杯内壁。
(3)A.蜡烛燃烧后质量减少,是因为生成的水蒸气和二氧化碳扩散到空气中,遵循质量守恒定律,该选项说法不正确;
B.根据O2+S![]() SO2,每32gS和32gO2完全反应后,生成64gSO2,该选项说法正确;
SO2,每32gS和32gO2完全反应后,生成64gSO2,该选项说法正确;
C.在化学反应aA+bB═cC+dD中,质量守恒是反应前后的总质量相等,不一定有:a+b=c+d,该选项说法不正确。故填B。
②设R相对分子质量为x,若参加反应的物质R与氧气的分子个数之比为1:3,根据题意有:![]() ,x=46,故填:46。
,x=46,故填:46。

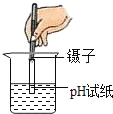
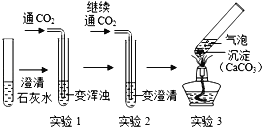
【题目】实验是学习化学的重要途径,小亮在学习酸碱盐的化学性质时做了如下实验,请你和他一起完成实验活动.
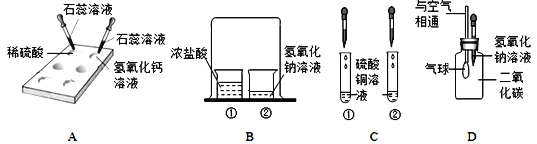
(1)在白色点滴板上完成实验A,请将实验现象补充完整.
稀硫酸 | 氢氧化钙溶液 | |
实验现象 | __________ | 溶液变蓝色 |
(2)在实验B的烧杯②中滴加2滴酚酞溶液后,扣上大烧杯,一段时间后看到的现象是_________,得出的结论是________。
(3)在实验C的试管①中,滴加少量的氢氧化钠溶液,看到的现象是________,反应的化学方程式是__________.要使试管②中产生白色沉淀,应滴加_________溶液(写化学式)。
(4)小亮用实验D验证二氧化碳与氢氧化钠溶液反应,看到的现象是_______。
【题目】某兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了塞上瓶塞.这瓶溶液有没有变质呢?同学们想一探究竟,请你和他们一起参与.
(查阅资料)氯化钡溶液显中性.
(提出猜想)假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液_____变质.
(实验验证)
实验步骤 | 实验现象 | 实验结论 |
①取少量该溶液于试管中,向其中滴加过量的氯化钡溶液; | 生成白色沉淀 | 假设_____不成立 |
②静置,向上层清液中滴加酚酞溶液. | _____ | 假设二成立 |
(讨论交流)
(1)步骤①滴加过量的氯化钡溶液的目的是_____;
(2)有同学提出用氢氧化钡溶液代替氯化钡溶液做同样的实验,也能看到相同的现象,得出相同的结论.你同意他的观点吗?为什么?_____.
(反思)氢氧化钠敞口放置变质的原因是_____(用化学方程式表示),因此氢氧化钠应_____保存.