题目内容
【题目】甲、乙、丙三位同学设计了如下图所示的A、B、C、D四个实验,并按图进行了实验操作,以此验证质量守恒定律。
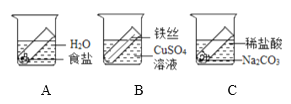
(1)实验A和B反应后天平依然平衡,由此小红认为这两个实验都能验证质量守恒定律,小亮认为小红是错误的,理由是____。
(2)实验B的反应化学方程式是____,反应前后溶液颜色的变化是____。
(3)实验C反应后天平不平衡的原因是_____,该实验_____(填“符合”或“不符合”)质量守恒定律,改用____装置可以直接验证质量守恒定律。
【答案】A是物理变化,质量守恒定律不适用于物理变化 Fe+CuSO4=Cu+FeSO4 蓝色变为绿色 反应生成的二氧化碳逸散到空气中 符合 密闭
【解析】
(1)实验A和B反应后天平依然平衡,由此小红认为这两个实验都能验证质量守恒定律,小亮认为小红是错误的,理由是:A是物理变化,质量守恒定律不适用于物理变化;
(2)实验B中铁丝与硫酸铜发生置换反应化学方程式是:Fe+CuSO4=Cu+FeSO4,反应前后溶液颜色的变化是: 蓝色变为绿色;
(3)实验C中碳酸钠与盐酸反应原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑;反应后天平不平衡的原因是:反应生成的二氧化碳逸散到空气中,该实验发生化学变化,符合质量守恒定律,改用密闭装置可以直接验证质量守恒定律。

 名校课堂系列答案
名校课堂系列答案【题目】某化学兴趣小组针对教科书中两个实验进行再探究。
(探究一)空气中氧气含量测定的再认识
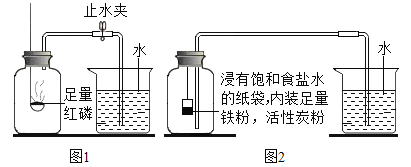
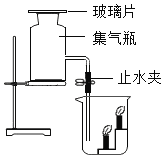
(1)测定装置如图1所示,红磷燃烧消耗氧气,使集气瓶内_____减小,烧杯中的水倒吸进入集气瓶。但该实验误差较大,测得空气中氧气含量明显低于![]() 。
。
(实验改进)根据铁在空气中生锈的原理设计实验如图2所示,装置中饱和食盐水、活性炭能加快铁生锈的速率,测得数据如下表:
实验前 | 实验后 | |
烧杯中水的体积/mL | 烧杯中剩余水的体积/mL | 集气瓶(扣除内容物)和导管的容积/mL |
80.8 | 54.5 | 126.0 |
(2)根据上表信息,空气中氧气的体积分数为_____(只列式,不计算)。
(3)从实验原理角度分析,改进后的实验结果更准确的原因是_____(写一点)。
(探究二)铁在氧气中燃烧后所得固体物质成分的探究
(问题1)铁燃烧时溅落下来的黑色物质中是否含有铁?
(资料)① 自然界中铁的氧化物主要是Fe3O4(黑色)和Fe2O3(红棕色)两种;
② FeO(黑色)极易被氧化为Fe2O3;
③ 铁的氧化物均能与稀盐酸或稀硫酸反应生成铁的化合物溶液。
(实验)将冷却后的黑色物质碾碎,装入试管,加入_____溶液,观察到_____的现象,说明铁燃烧时溅落下来的黑色物质中含有铁。
(问题2)铁燃烧的产物为什么不是Fe2O3?
(资料)① Fe3O4和Fe2O3的分解温度、铁的熔点见表;
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 | — |
熔点/℃ | — | — | 1535 |
② Fe2O3高温时分解成Fe3O4。
(证据推理)根据实验现象及表中信息可知,铁在氧气里燃烧时产生的高温应在_____之间,此时Fe2O3已分解。
(拓展延伸)(1)为了防止集气瓶炸裂,必须采取_____的措施。
(2)某食品密封包装盒的透明盖内放有黑色的FeO粉末,若颜色_____,说明包装盒漏气。
(3)Fe2O3高温时会分解成Fe3O4和一种气体,该反应的化学方程式为_____。
【题目】在研究酸和碱的化学性质时,某小组想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案设计、实施和评价。
(1)探究稀H2SO4与NaOH溶液的反应。
当滴入几滴酚酞溶液后,溶液由无色变为______色。根据上述实验中颜色变化,确定稀H2SO4与NaOH溶液发生了化学反应。反应的化学方程式为______。
(2)探究上述稀H2SO4与NaOH溶液反应后烧杯中的硫酸是否过量。
①根据上述反应过程中溶液变成无色,不能确定稀H2SO4是否过量,同学们又分别选取BaCl2、紫色石蕊溶液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的BaCl2溶液 | 出现白色沉淀 | 稀H2SO4过量 |
方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 稀H2SO4过量 |
上述设计的实验方案中,正确的是__________(选填:方案一、方案二)。另外一个实验方案错误的原因是:____________。
②你认为下列药品或方法也能确定稀H2SO4过量的有__________(填字母代号)。
A加入碳酸钠 B加入锌粒 C加入氢氧化镁 D测定溶液pH
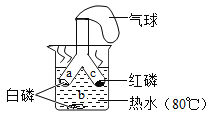
【题目】当把燃着的小蜡烛放入一个集气瓶中并塞紧胶塞时,蜡烛一会儿就熄灭了。那么,蜡烛为什么会熄灭呢?某化学兴趣小组进行了如下探究,请完成以下填空。
(提出猜想)
猜想1:蜡烛燃烧把集气瓶内的氧气耗尽,导致蜡烛熄灭。
猜想2:蜡烛燃烧随集气瓶内氧气含量降低而变弱,放出热量减少,使温度降至蜡烛的着火点以下,导致蜡烛熄灭。
猜想3:蜡烛燃烧产生的二氧化碳能灭火,导致蜡烛熄灭。
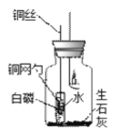
(进行实验)小组设计如下图所示的实验装置,并进行实验来验证猜想。
| 实验操作 | 实验现象 |
点燃蜡烛并连同胶塞上的其他仪器和药品一起放入集气瓶中,塞紧胶塞。 | 蜡烛火焰逐渐变弱,最终熄灭。 | |
蜡烛熄灭并静置冷却后,将铜丝上提,使盛白磷的铜网勺高于试管口,试管倒下,水流出。 | 一会儿后,白磷燃烧,有大量的____产生。 |
(分析和结论)
(1)蜡烛熄灭前,白磷要浸没在小试管所盛的水中,其目的是______。
(2)集气瓶中装入生石灰的目的是利用生石灰与水接触发生反应,其化学方程式是_____,且该反应将____(填“吸热”或“放热”),使瓶内温度升高。
(3) 瓶内的白磷能燃烧,证明猜想____和_____不成立。
(反思与交流)
(4) 通过本实验可知,燃烧的条件之一“燃烧需要氧气”这一条件应补充完善为______。