题目内容
【题目】某校研究学习小组用右图装置进行镁条在空气中燃烧的实验:
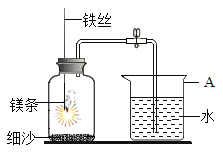
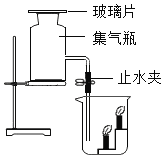
(1)镁条燃烧,冷却后打开止水夹,若弹簧夹未夹紧,则进入集气瓶的水会偏________(填“多”或“少”)。
(2若镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的________%。
[查阅资料]
(3)镁条在氮气中燃烧,生成氮化镁(Mg3N2 )固体,反应的方程式为_________,镁条还可以在二氧化碳中燃烧生成一种单质和一种金属氧化物,反应的化学方程式为_______。
(4)通过以上探究,你对燃烧的有关知识有了什么新的认识?_______。
【答案】多 21 3Mg+N2![]() Mg3N2 2Mg+CO2
Mg3N2 2Mg+CO2![]() 2MgO+C 燃烧不一定需要氧气
2MgO+C 燃烧不一定需要氧气
【解析】
(1)镁条燃烧,放出大量的热,若弹簧夹未夹紧,会有部分空气排出装置,冷却后打开止水夹,则进入集气瓶的水会偏多。
(2若镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过空气中氧气的体积含量21%。
(3)镁条在氮气中燃烧,生成氮化镁(Mg3N2 )固体,反应的方程式为:3Mg+N2![]() Mg3N2镁条还可以在二氧化碳中燃烧生成碳单质和一种金属氧化物氧化镁,反应的化学方程式为2Mg+CO2
Mg3N2镁条还可以在二氧化碳中燃烧生成碳单质和一种金属氧化物氧化镁,反应的化学方程式为2Mg+CO2![]() 2MgO+C
2MgO+C
(4)通过以上探究,你对燃烧的有关知识有了什么新的认识:燃烧不一定需要氧气。

【题目】3.0g某物质完全燃烧后生成4.4gCO2和1.8g水.则对该物质相关判断正确的是( )
| A. | 该物质只含碳、氢元素 |
| B. | 该物质一定含有碳、氢元素,可能含有氧元素 |
| C. | 该物质由碳、氢、氧元素组成 |
| D. | 该物质分子中碳原子和氢原子的个数比为1:1 |
【题目】在研究酸和碱的化学性质时,某小组想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案设计、实施和评价。
(1)探究稀H2SO4与NaOH溶液的反应。
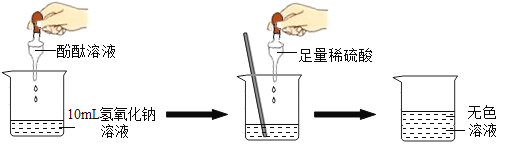
当滴入几滴酚酞溶液后,溶液由无色变为______色。根据上述实验中颜色变化,确定稀H2SO4与NaOH溶液发生了化学反应。反应的化学方程式为______。
(2)探究上述稀H2SO4与NaOH溶液反应后烧杯中的硫酸是否过量。
①根据上述反应过程中溶液变成无色,不能确定稀H2SO4是否过量,同学们又分别选取BaCl2、紫色石蕊溶液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的BaCl2溶液 | 出现白色沉淀 | 稀H2SO4过量 |
方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 稀H2SO4过量 |
上述设计的实验方案中,正确的是__________(选填:方案一、方案二)。另外一个实验方案错误的原因是:____________。
②你认为下列药品或方法也能确定稀H2SO4过量的有__________(填字母代号)。
A加入碳酸钠 B加入锌粒 C加入氢氧化镁 D测定溶液pH
【题目】实验是科学探究的重要方法。如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题。已知:铜+氧气→氧化铜(黑色固体)
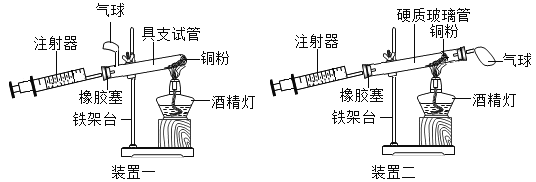
(1) 根据下表提供的实验数据,完成下表
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
25mL | 15mL | 9mL | _________________。 |
(2)装置一和装置二中气球的位置不同,_________________装置 (填“一”或“二”)更合理。