题目内容
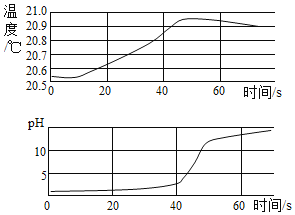
【题目】纯碱产品中常含有少量的氯化钠杂质,在实验室中取50g纯碱样品,平均分成五份依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为30g),每次充分反应后都进行称量,得到的实验数据如表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入纯碱样品的质量/g | 10 | 10 | 10 | 10 | 10 |
电子天平的示数/g | 137.8 | a | 153.4 | 161.2 | 171.2 |
(1)a的值为_____。
(2)计算纯碱样品中碳酸钠的质量_____。
(3)计算所用稀盐酸的溶质质量分数_____。
【答案】145.6 21.2g 14.6%
【解析】
(1)依据第一次10g纯碱样品反应后天平的示数可知,每次加入10g样品生成二氧化碳的质量是:30g+100g+10g﹣137.8g=2.2g
则第二次加入10g样品后天平的示数是137.8g+10g﹣2.2g=145.6g
(2)第四次加入碳酸钠后质量不再减少,说明4次反应后生成的二氧化碳质量是50g+100g+30g﹣171.2g=8.8g
设40g样品中碳酸钠的质量是x,稀盐酸中溶质的质量是y

x=21.2g
y=14.6g
(3)所用稀盐酸的溶质质量分数![]() 。
。

【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
[查阅资料]铁的活动性比铜强.
[进行猜想]对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu; 猜想二:_______________; 猜想三:Fe>Cu>R
[收集证据]为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究.
主要操作 | 主要现象 | 实验结论 | |
甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | ______________ | 猜想一 正确 |
乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率___(填“快”或“慢”) | |
丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R丝在空气中剧烈燃烧,铁丝在 空气中______ |
写出铁丝在氧气中燃烧的化学方程式__________________________________
[交流反思]三位同学交流讨论后认为,比较金属活动性强弱的方法有多种.
[归纳总结]他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与_____是否反应.
【题目】金属钴和锰及它们的化合物用途广泛,请根据题目回答。
(1)部分锰的化合物的颜色及溶解性见下表:
物质 | KMnO4 | MnO2 | MnO | Mn3O4 | MnSO4 | MnCO3 |
颜色 | 黑色 | 黑色 | 绿色 | 黑色 | 白色 | 白色 |
溶解性 | 易溶 | 难溶 | 难溶 | 难溶 | 易溶 | 难溶 |
①上述固体中,显绿色的是_____。
②若向 MnSO4 溶液的试管中滴入 Na2CO3 溶液,化学方程式是_____。
③下图表示上述反应前后溶液中存在的主要离子,写出以下图形代表的离子:______、______
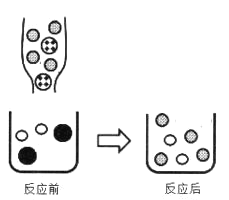
![]()
(2)已知 Co2O3 固体黑色粉末,CoSO4 溶液是粉红色的。向盛有 Co2O3 的试管里加入稀硫酸, 发生反应 2Co2O3+4H2SO4===4CoSO4+O2↑+4H2O。预设观察到的现象是______
【题目】密闭容器中甲、乙、丙、丁四种物质在一定条件下发生化学反应,不同时刻的质量如表所示。
甲的质量/g | 乙的质量/g | 丙的质量/g | 丁的质量/g | |
反应前 | 64 | 10 | 1 | 16 |
t时刻 | 32 | a | b | c |
反应后 | 0 | 42 | d | 48 |
已知甲的相对分子质量为丁的2倍,下列有关说法错误的是( )
A. a为32
B. 该反应属于分解反应
C. 丙可能是催化剂
D. 该反应的化学方程式中甲与丁的化学计量数之比为1:1